健忘症やPTSD(心的外傷後ストレス障害)といった記憶の異常を伴う病気への対処法を見つけるためには、学習・記憶の分子メカニズムの研究が欠かせません。そのメカニズムにおいて重要な役割を果たすのが、脳の中にたくさん含まれているタンパク質リン酸化酵素、Ca2+/カルモジュリン依存性プロテインキナーゼIIα(Ca2+/calmodulin-dependent protein kinase IIα, CaMKIIα)です。CaMKIIαは、神経細胞同士の情報伝達の場であるシナプスの後部に特に多く存在し、学習・記憶の基本現象とされるシナプスの長期増強(long-term potentiation, LTP)に不可欠の分子と考えられています。私達は、その生体内での役割をより詳しく調べるために、このキナーゼの酵素活性をなくしたノックインマウス[CaMKIIα (K42R)-knock-in mouse, CaMKIIα-KI]を作製し、生化学・細胞生物学・組織化学・電気生理学・行動科学など様々な手法を用いて解析すると共に、生理学研究所内外の研究者と共同研究を進めています。現在、これらマウスの学習・記憶行動解析を通して、脳疾患や病態との関連、特に加齢に伴う認知機能低下とキナーゼ活性との関連について、重点的に調べています。
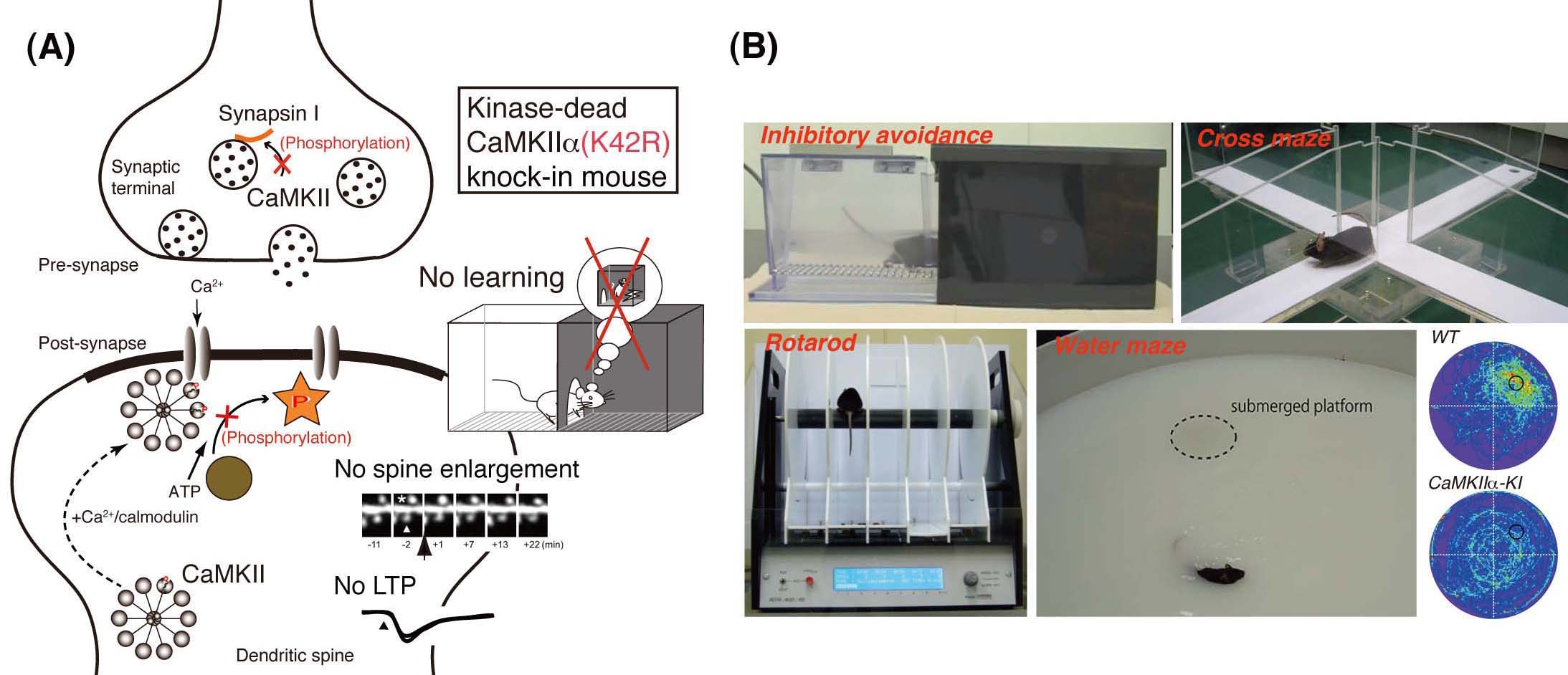 (A) CaMKIIαのキナーゼ活性をなくしたノックインマウス[CaMKIIα (K42R)-knock-in mouse, CaMKIIα-KI]では、海馬シナプスの長期増強(long-term potentiation, LTP)や学習・記憶の障害が顕著に認められます。(B) 様々な課題を用いた行動解析を行うことにより、脳疾患や病態との関連を調べています。
(A) CaMKIIαのキナーゼ活性をなくしたノックインマウス[CaMKIIα (K42R)-knock-in mouse, CaMKIIα-KI]では、海馬シナプスの長期増強(long-term potentiation, LTP)や学習・記憶の障害が顕著に認められます。(B) 様々な課題を用いた行動解析を行うことにより、脳疾患や病態との関連を調べています。
*Yamagata, Y. and Nairn, A.C. (2015) Contrasting features of ERK1/2 activity and synapsin I phosphorylation at the ERK1/2-dependent site in the rat brain in status epilepticus induced by kainic acid in vivo. Brain Res. 1625: 314-323.
doi: 10.1016/j.brainres.2015.08.023.
*Yamagata, Y., Kaneko, K., Kase, D., Ishihara, H., Nairn, A.C., Obata, K. and Imoto, K. (2013) Regulation of ERK1/2 mitogen-activated protein kinase by NMDA-receptor-induced seizure activity in cortical slices. Brain Res. 1507: 1-10.
doi: 10.1016/j.brainres.2013.02.015.
*Yamagata, Y., et al. (2009) Kinase-dead knock-in mouse reveals an essential role of kinase activity of Ca2+/calmodulin-dependent protein kinase IIα in dendritic spine enlargement, long-term potentiation, and learning. J. Neurosci. 29: 7607-7618.
doi: 10.1523/JNEUROSCI.0707-09.2009.