| ワサビ受容体TRPA1はさまざまな痛み刺激を感知する受容体で、鎮痛薬開発の重要な標的です。今回、自然科学研究機構生理学研究所(岡崎統合バイオサイエンスセンター)の富永真琴教授、齋藤茂助教、Rupali Gupta 研究員と分子科学研究所の奥村久士准教授の研究グループは、TRPA1の特異的阻害剤HC-030031の作用が動物の種によって異なることを利用し、その作用部位を同定しました。この成果は、新たな鎮痛薬開発につながるものと期待されます。本研究結果は、Scientific Reports誌に掲載されました(日本時間11月22日オンライン版掲載)。 |
私たちは痛み刺激を感覚神経で感知します。感覚神経にある重要な痛み刺激センサーとしてカプサイシン受容体TRPV1(ティー・アール・ピー・ヴィワン)とワサビ受容体TRPA1(ティー・アール・ピー・エイワン)1があります。トウガラシやワサビで感じる「辛み」は味覚ではなく、痛みです。
1997年にTRPV1の遺伝子が報告されてから18年経ち、その阻害剤はよい鎮痛薬になると期待されてきましたが、未だに鎮痛薬として世に出ていません。2003年に報告されたTRPA1も鎮痛薬開発の標的候補として重要です。電子顕微鏡を用いた解析で、2013年にTRPV1の、2015年にTRPA1の原子レベルでの構造が明らかにされ、構造から鎮痛薬開発に迫れるようになりました。
今回、我々の研究グループは、ワサビ受容体TRPA1の特異的阻害剤として知られるHC-030031が作用するアミノ酸を同定しました。HC-030031は、ヒト、マウス、ニワトリ、グリーンアノールトカゲのTRPA1機能を阻害しますが、カエルのTRPA1機能は阻害しません(図1)。そこで、ヒトTRPA1とカエルTRPA1のアミノ酸情報を比較することで、HC-030031の作用部位の同定を目指すことにしました(図2)。TRPA1の1つのサブユニットは6回の膜貫通構造を持っていて細胞内に存在します。そこで、ヒトTRPA1とカエルTRPA1のキメラ体を作成し、電気生理学的手法を用いて解析したところ、第5膜貫通ドメインから第6膜貫通ドメインのあたりがHC-030031の阻害効果に重要であることが分かりました。次に、HC-030031に感受性のある4つの種のTRPA1とカエルTRPA1のアミノ酸配列を比較して作成した点変異体を解析して、第4膜貫通ドメインと第5膜貫通ドメインの間のループにある1つのアミノ酸アスパラギンが重要であることを見いだしました(図3)。また、このアスパラギン(N855)がカルボキシル末端と一緒になってHC-030031の阻害効果に関わっていることも明らかになりました。さらに、分子動力学シミュレーションによって、HC-030031がヒトTRPA1のN855に安定的に結合することが確認されました(図3)。TRPA1の阻害剤は鎮痛薬として期待されることから、このHC-030031の作用標的の同定は新たな鎮痛薬開発につながるものと期待されます。
富永真琴教授は、「今回の研究で、これまで謎であったTRPA1のHC-030031の作用部位を明らかにすることができました。TRPA1の原子レベルでの構造は明らかになっており、構造からTRPA1に作用する鎮痛薬開発を進めるアプローチが加速されることが期待されます。」と話しています。
本研究は文部科学省科学研究費補助金の補助を受けて行われました。
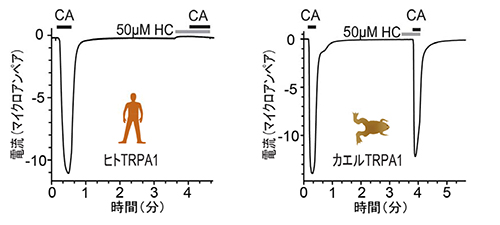
HC-030031 (HC)が存在するとCA (シナモンの辛み成分)はヒトTRPA1を活性化することができません(左)が、CAによるカエルTRPA1の活性化はHCで阻害されません(右)。
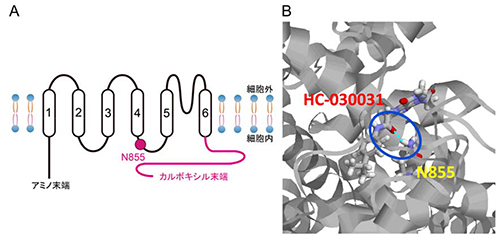
(A) TRPA1の1つのサブユニットの膜トポロジーモデル。6回の細胞膜貫通ドメインがあり、ヒトTRPA1の第4膜貫通ドメインと第5膜貫通ドメインの間にある細胞内ループの855番目のアスパラギン (N855)がHCの阻害に関わることが明らかになりました。(B) 分子動力学シミュレーションで得られたヒトTRPA1(リボンモデル)のN855(棒モデル)とHC(棒モデル)の結合構造を示します。青丸の部分がN855とHCの水素結合(水色点線)に関わる原子を示します。
ヒトワサビ受容体TRPA1に対する阻害剤HC-030031の作用標的が明らかになったことで、TRPA1を標的とした新たな鎮痛薬開発が加速されることと期待されます。
Structural basis of TRPA1 inhibition by HC-030031 utilizing species-specific differences
Rupali Gupta, Shigeru Saito, Yoshiharu Mori, Satoru G. Itoh, Hisashi Okumura and Makoto Tominaga. Scientific Reports. in Press
<研究について>
自然科学研究機構 生理学研究所(岡崎統合バイオサイエンスセンター)
細胞生理研究部門
教授 富永 真琴 (トミナガ マコト)
自然科学研究機構 生理学研究所 細胞生理研究部門
助教 齋藤 茂 (サイトウ シゲル)
<広報に関すること>
自然科学研究機構 生理学研究所 研究力強化戦略室
自然科学研究機構 分子科学研究所 広報室


![]()
自然科学研究機構 生理学研究所 研究力強化戦略室
自然科学研究機構 分子科学研究所 広報室