|
抗がん剤を用いる化学療法は、全身性がん治療の第一選択です。しかし、抗がん剤は疲労感/倦怠感や筋肉痛、ひどい場合は心筋症といった副作用を起こすことが問題視されています。原因は心筋や骨格筋などの萎縮であることは知られていましたが、抗がん剤が筋萎縮を起こす機構は不明でした。 今回、生理研の西田基宏教授(九州大学教授兼務)は、九州大学、群馬大学、東京大学、京都大学との共同研究において、心筋細胞膜に存在し、抗がん剤投与により発現増加するTRPC3チャネルが、活性酸素を発生することで心筋細胞を萎縮することを発見。実際、TRPC3チャネルを阻害する化合物が、抗がん剤誘発性の心不全を軽減することを明らかにしました。 本研究結果は、米国医学誌が発行するJCI insight誌に掲載されます(平成29年8月3日日本時間午後10時 オンライン版掲載)。 |
がんは、我が国で最も死亡率の高い病気であり、日本人の2人に1人が罹患するといわれています。抗がん剤治療(化学療法)は、手術および放射線治療と並ぶ「がん治療の3本柱」の1つとして、高い医療実績を誇っています。その一方で、化学療法を続けることにより、筋力低下による疲労感/倦怠感や廃用(寝たきり)症候群、心筋症といった副作用が起こりうることが問題視されています。しかし、抗がん剤が筋力低下を起こす原因についてはよくわかっていませんでした。
私たちのグループは昨年、心筋細胞膜上に存在するCa2+透過型カチオンチャネル(transient receptor potential canonical (TRPC) 3)が、酸化ストレスの原因となる活性酸素の生成酵素である細胞膜タンパク質NADPHオキシダーゼ2(Nox2)と相互作用し、Nox2タンパク質の分解を抑制(安定化に寄与)していることを報告しました。さらにTRPC3チャネルは心筋細胞の物理的伸展刺激により活性化し、Nox2からの活性酸素生成を促すことで、心臓の線維化(硬化)を誘導することも明らかにしてきました(図1)。
今回私たちは、高用量のアントラサイクリン系抗がん剤ドキソルビシン(商品名:アドリアシン)が、心臓において急性期にTRPC3-Nox2タンパク複合体数を増加し、酸化ストレスを誘発することで心筋細胞を萎縮させることを、マウスを用いて明らかにしました(図2)。ドキソルビシン投与は、心筋細胞の「低酸素化」を誘発することでTRPC3タンパク質の発現を増加し、TRPC3がNox2タンパク質を安定化することでNox2依存的な活性酸素の生成を促し、結果的に心筋細胞を萎縮させることがわかりました。TRPC3とNox2の相互作用を特異的に阻害するタンパク質をマウスの心筋細胞特異的に発現させたところ、ドキソルビシン投与によるマウスの心筋萎縮と心機能低下が軽減されました。さらに、TRPC3チャネルを阻害することが報告されている複数の化合物の中から、TRPC3-Nox2複合体形成も抑制できる化合物pyrazole-3を同定し、pyrazole-3がドキソルビシン誘発性の心筋萎縮を顕著に抑制することも明らかにしました。
一方、適度な運動がマウスのドキソルビシン心毒性を軽減することも過去に報告されています。適度な運動を与え続けたアスリートモデルマウスの心臓ではTRPC3-Nox2複合体形成が抑制されていました。TRPC3遺伝子欠損マウスの心機能を解析した結果、やはりアスリートモデルマウスの心臓と同様にコンプライアンス(弾性と伸展性)の高い柔軟な心筋を呈していることがわかりました。TRPC3チャネル活性だけを変化させても心筋の柔軟性は変化しないことから、TRPC3-Nox2複合体形成の阻害が、適度な運動を模倣することで、抗がん剤投与による急性期の心筋萎縮を抑制する可能性が示されました(図3)。
本研究により、TRPC3-Nox2複合体形成が抗がん剤誘発性の心筋萎縮を引き起こす原因となることが明らかとなりました。今後、TRPC3チャネル活性およびTRPC3-Nox2相互作用を阻害する薬と抗がん剤の併用療法の開発が、健康長寿社会の実現や医療経済的負担の軽減に大きく貢献するものと期待されます。
本研究は国立研究開発法人科学技術振興機構(JST)・戦略的創造研究推進事業(さきがけ)の研究領域「疾患における代謝産物の解析および代謝制御に基づく革新的医療基盤技術の創出」における研究開発課題「硫黄循環・代謝を基軸とした生体レドックス恒常性制御基盤の構築」(代表:西田 基宏教授)の一環で行われたと共に、日本学術振興会の科学研究費補助金、文部科学省の新学術領域「酸素生物学」、内藤記念財団、大幸財団などの研究助成、ならびに日本医療研究開発機構(AMED)「創薬等ライフサイエンス研究支援基盤事業(九大拠点)」による支援を受けて行われました。
TRPC3チャネル活性およびTRPC3-Nox2相互作用を阻害する薬と抗がん剤の併用療法の開発は、化学療法の安全な継続使用が可能になり、適応疾患の幅も広がる可能性が期待されます。また、今回明らかにした心筋萎縮のメカニズムは、薬剤誘発性の筋萎縮だけでなく、廃用性筋萎縮(寝たきりなど運動量低下による筋力低下)にも関与している可能性があり、TRPC3-Nox2複合体を標的とする薬の開発が健康長寿社会の実現に大きく貢献する可能性も期待できます。
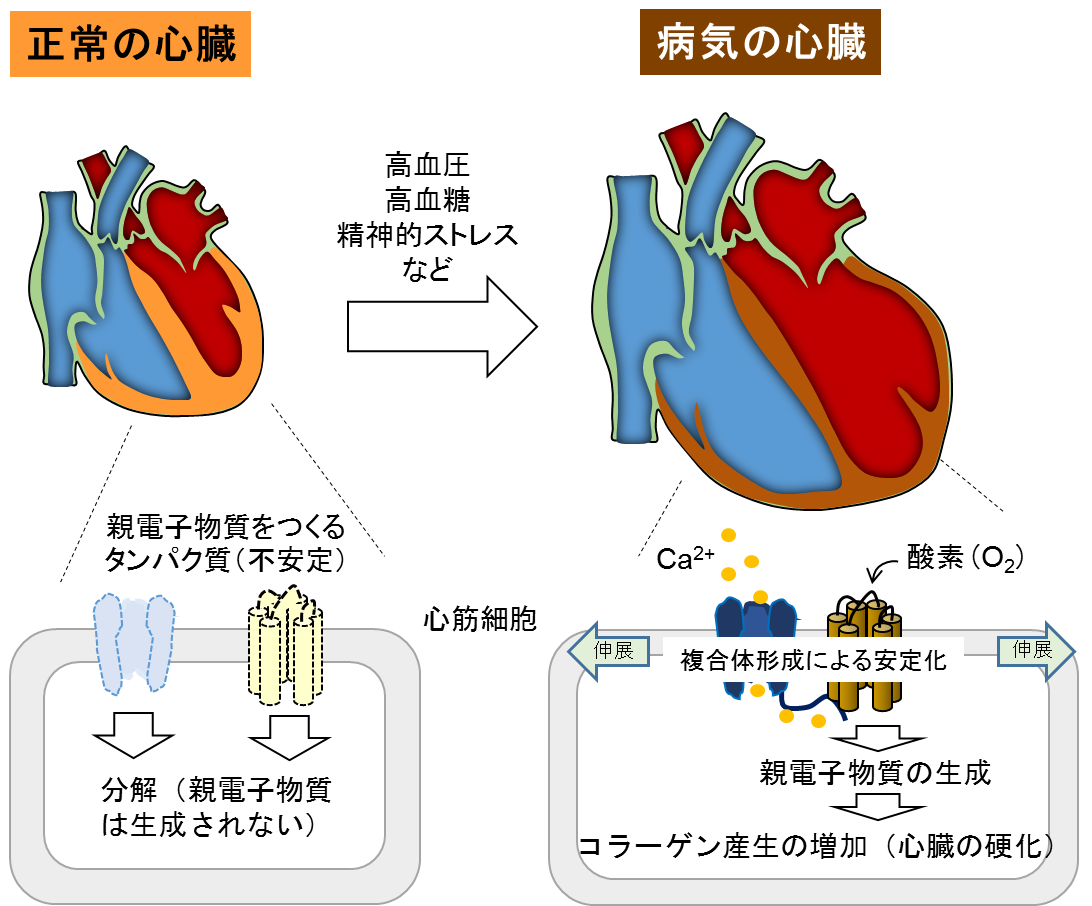
高血圧や大動脈狭窄による血行力学的な圧負荷を心臓が慢性的に受け続けると、心筋は肥大するものの心臓組織全体的に硬くなるため、十分な拡張ができなくなり、やがて機能不全に至ります。心臓が硬くなる原因として間質の線維化(コラーゲン線維の蓄積)が知られています。心筋細胞および心線維芽細胞膜では持続的な圧負荷によりTRPC3チャネルタンパク質と活性酸素の生成酵素(NADPHオキシダーゼ(Nox2))の安定な複合体が形成され、機械的伸展刺激によるTRPC3チャネル活性化を介したNox2活性化が酸化ストレスの原因となる活性酸素や親電子物質の生成を促進し、結果的にコラーゲン産生を増加させることを明らかにしました(Kitajima & Tomita T et al., Sci. Rep. 2016参照)。
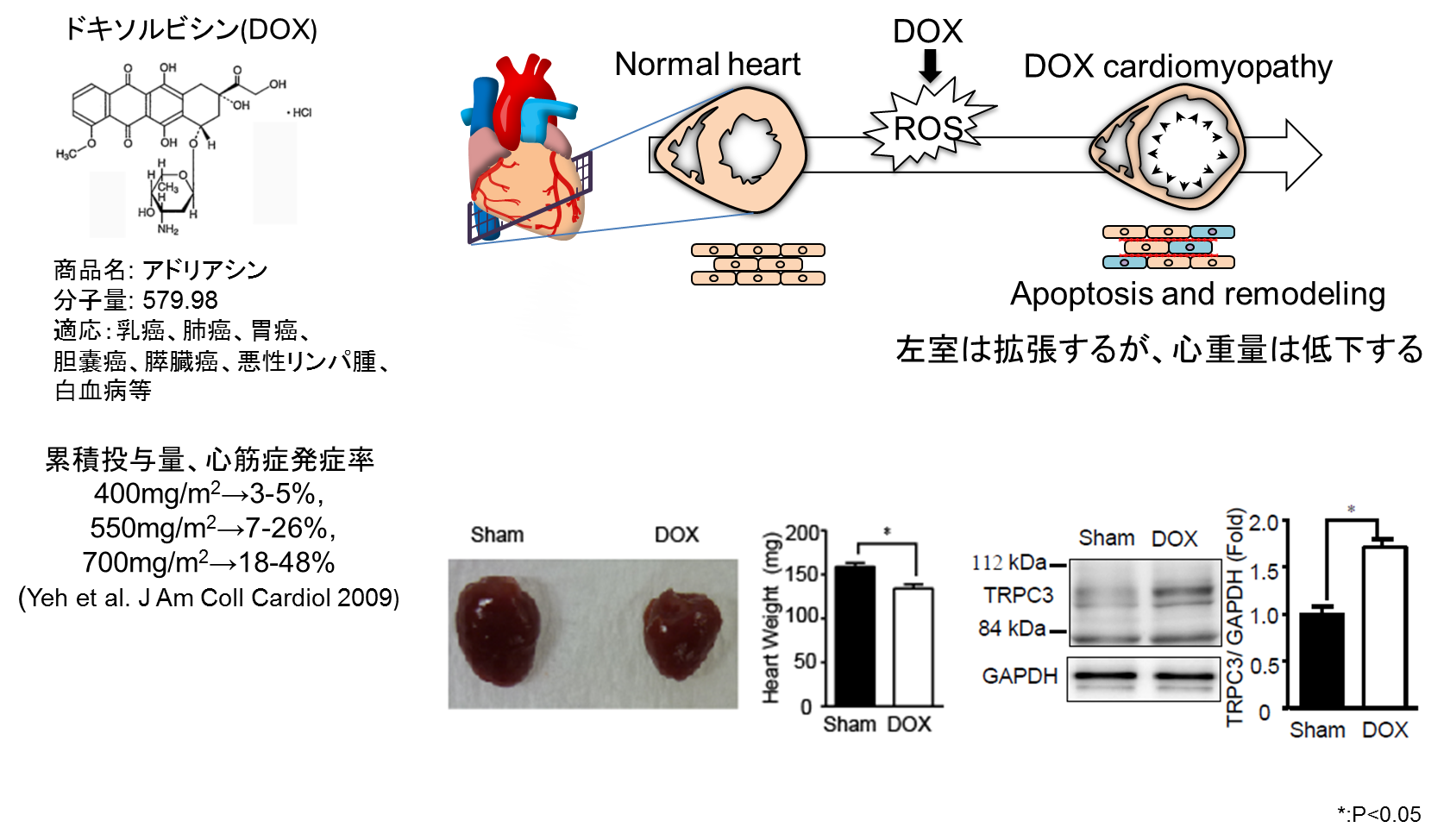
アントラサイクリン系抗がん剤ドキソルビシン(DOX)の累積投与が心筋症発症リスクを高めること、心筋細胞死が起こる前段階で心筋萎縮が起こることが知られています。私たちはDOX投与マウス心臓で心重量の減少と逆相関的にTRPC3やNox2タンパク質の発現量が増大することを発見しました。TRPC3-Nox2タンパク質の発現増加を抑制することで、DOX誘発性の心筋萎縮とそれに伴う心機能低下が抑制されることを明らかにしました。
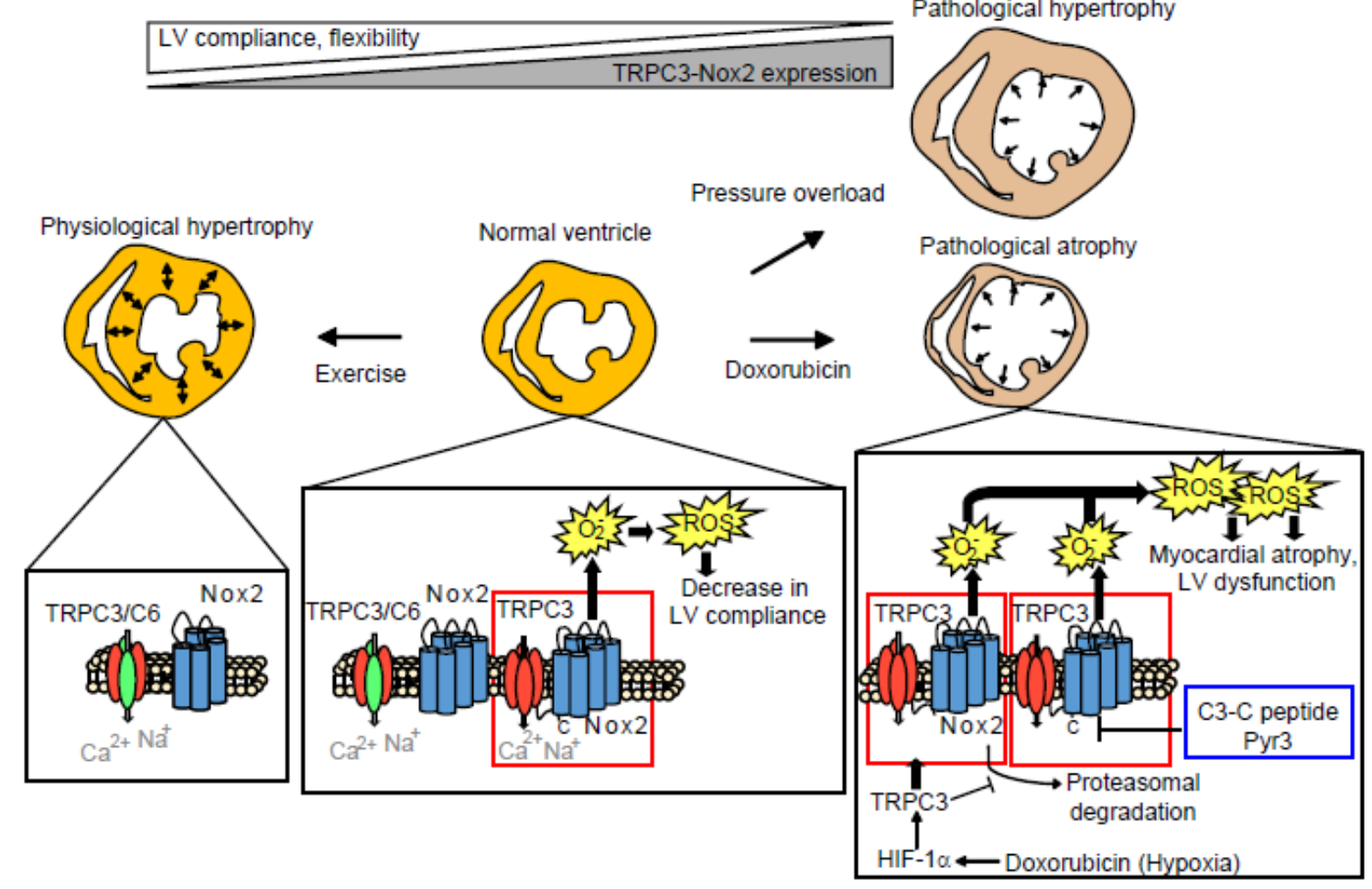
TRPC3チャネルを欠損あるいは阻害し、Nox2タンパク質の安定性を低下させたマウスの心臓は、あたかも適度な運動を与え続けたマウスの心臓のように、柔軟かつ高い弾性・伸展性(コンプライアンス)を示します。自発的な運動を与え続けたマウスの心臓は肥大(生理的肥大)しているものの、TRPC3-Nox2タンパク質複合体数が顕著に低下します。TRPC3チャネル活性およびTRPC3-Nox2複合体形成の阻害により心筋コンプライアンスは高く維持され、ドキソルビシン心筋萎縮も起こらなくなります。
Shimauchi T, Numaga-Tomita T, Ito T, Nishimura A, Matsukane R, Oda S, Hoka S, Ide T, Koitabashi N, Uchida K, Sumimoto H, Mori Y and Nishida M.
TRPC3-Nox2 complex mediates doxorubicin-induced myocardial atrophy.
JCI Insight. 2017;2(15):e93358. https://doi.org/10.1172/jci.insight.93358.
<研究について>
大学共同利用機関法人 自然科学研究機構 生理学研究所
心循環シグナル研究部門
大学法人 九州大学 大学院薬学研究院 創薬育薬研究施設統括室(併任)
教授 西田 基宏(ニシダ モトヒロ)
<広報に関すること>
大学共同利用機関法人 自然科学研究機構 生理学研究所
研究力強化戦略室
国立大学法人群馬大学昭和地区事務部総務課
広報係長 田原 美粧(たはら みさ)
国立大学法人 九州大学 広報室
国立大学法人 京都大学 企画・情報部広報課国際広報室
今羽右左 デイヴィッド 甫
東京大学大学院農学生命科学研究科・農学部
総務課総務チーム(広報情報担当)





自然科学研究機構 生理学研究所
国立大学法人 群馬大学
国立大学法人 九州大学
国立大学法人 京都大学
国立大学法人 東京大学