山梨大学医学部薬理学講座 小泉修一教授及び篠崎陽一講師の研究チームは、山梨大学医学部眼科学講座柏木賢治准教授、(公財)東京都医学総合研究所視覚病態プロジェクト 原田高幸参事研究員、生理学研究所分子神経生理部門 大野伸彦准教授(現自治医科大学)、ブリュッセル大学 Bernard Robaye教授、国立病院機構東京医療センター臨床研究センター分子細胞生物学研究部 岩田岳部長のチームと共同で、眼圧をコントロールする新しいメカニズムを発見しました。研究チームは、マウスを使った実験によって「細胞外ヌクレオチド[1]」とその「受容体[2]」であるP2Y6受容体が眼圧のコントロールに重要であること、またP2Y6受容体の欠損によって眼圧が上昇し、「緑内障[3]」に類似した症状を引き起こすことを発見しました。この発見により、本受容体の機能低下が緑内障発症リスクを上昇させる原因の1つである可能性が示されました。
緑内障は、日本における中途失明原因第一位の疾患です。有病率は40歳以上で5%[4]と言われており、その割合は加齢に伴いさらに上昇します。緑内障発症の最大のリスク因子の1つとして、「眼圧[5]」があります。眼圧が上昇する事により、視神経が傷害されやすくなると考えられています。従って、緑内障の進行を遅らせるための治療として眼圧を下げる処置がとられます。既に複数の眼圧を下げる点眼薬が用いられていますが、様々な副作用、単一の薬剤では効果が不十分な場合があること、薬剤の効果が徐々に減弱または消失する事がある、などの問題から新たな治療法の開発が喫緊の課題になっていました。
眼圧は「眼房水[6]」の産生と排出のバランスによって決まります、これらをコントロールする生体分子や受容体として様々なものが既に知られています。過去の研究成果より、眼の体液である眼房水にもヌクレオチドが存在する事、生理的な刺激に応じて眼の組織からヌクレオチドが放出される事、緑内障患者の眼房水には健常者に比べて非常に高濃度のヌクレオチドが含まれる事、などから研究チームは細胞外ヌクレオチドとその受容体であるP2受容体の異常が緑内障の発症に寄与する、との仮説を立てました。
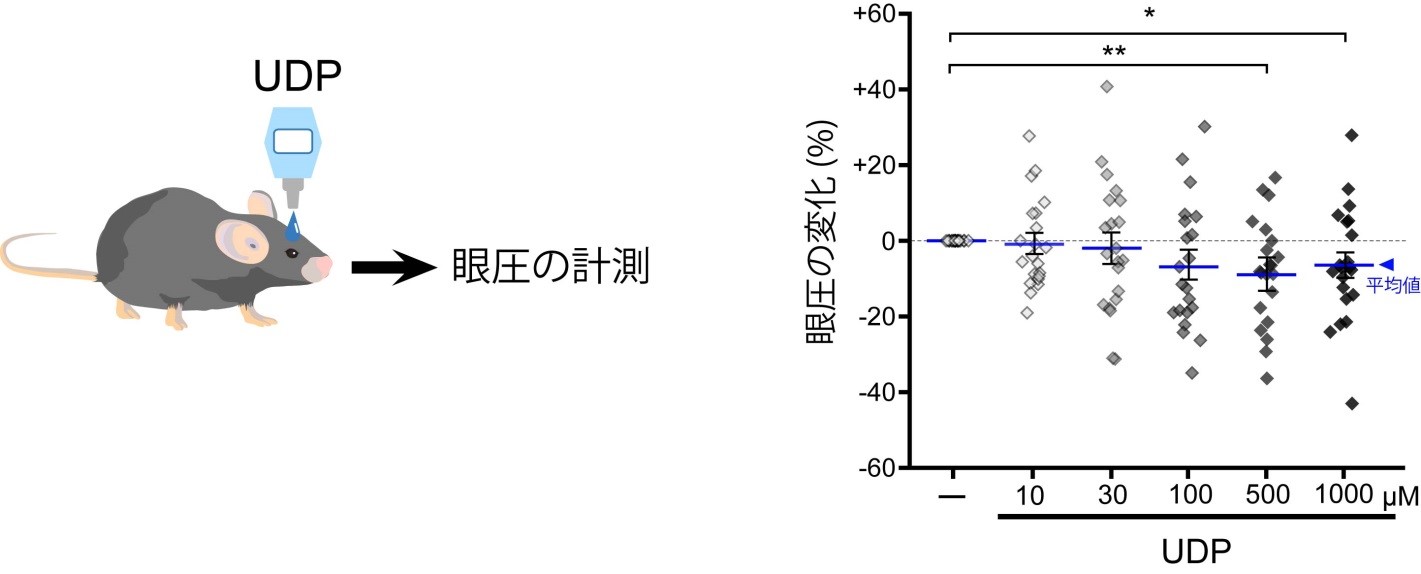
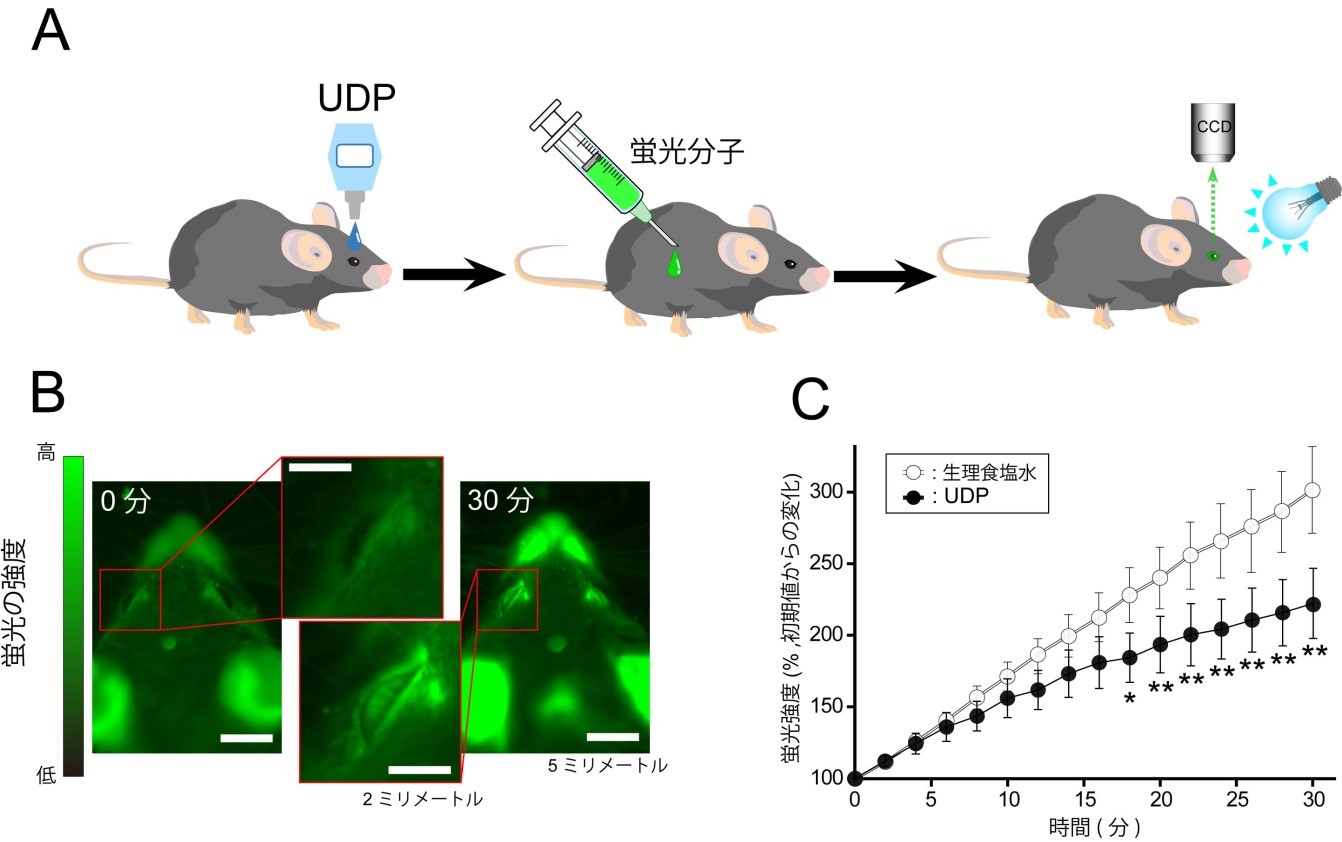
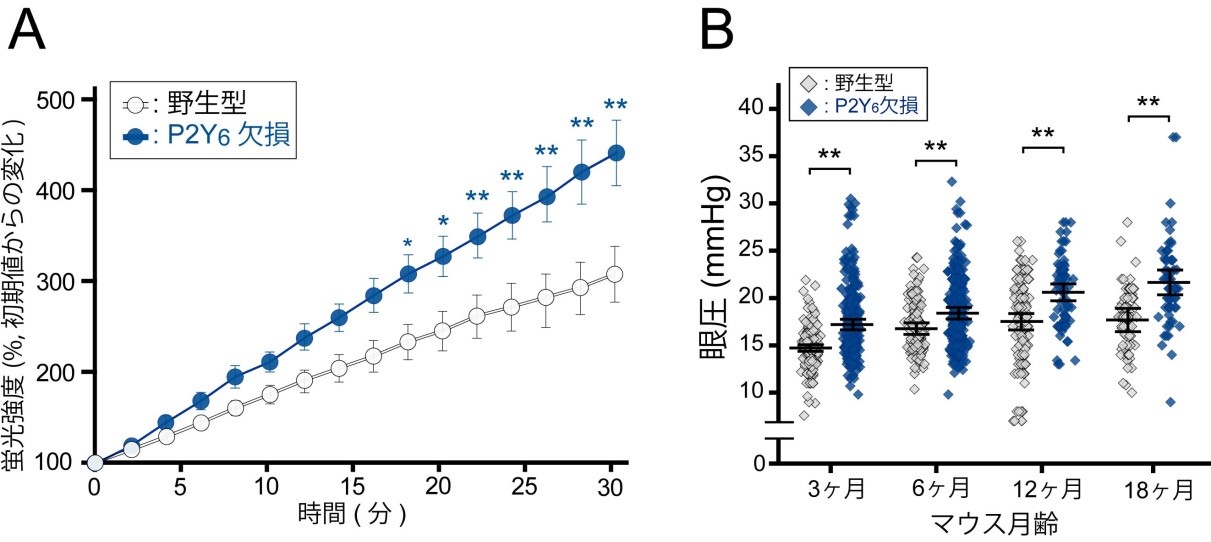
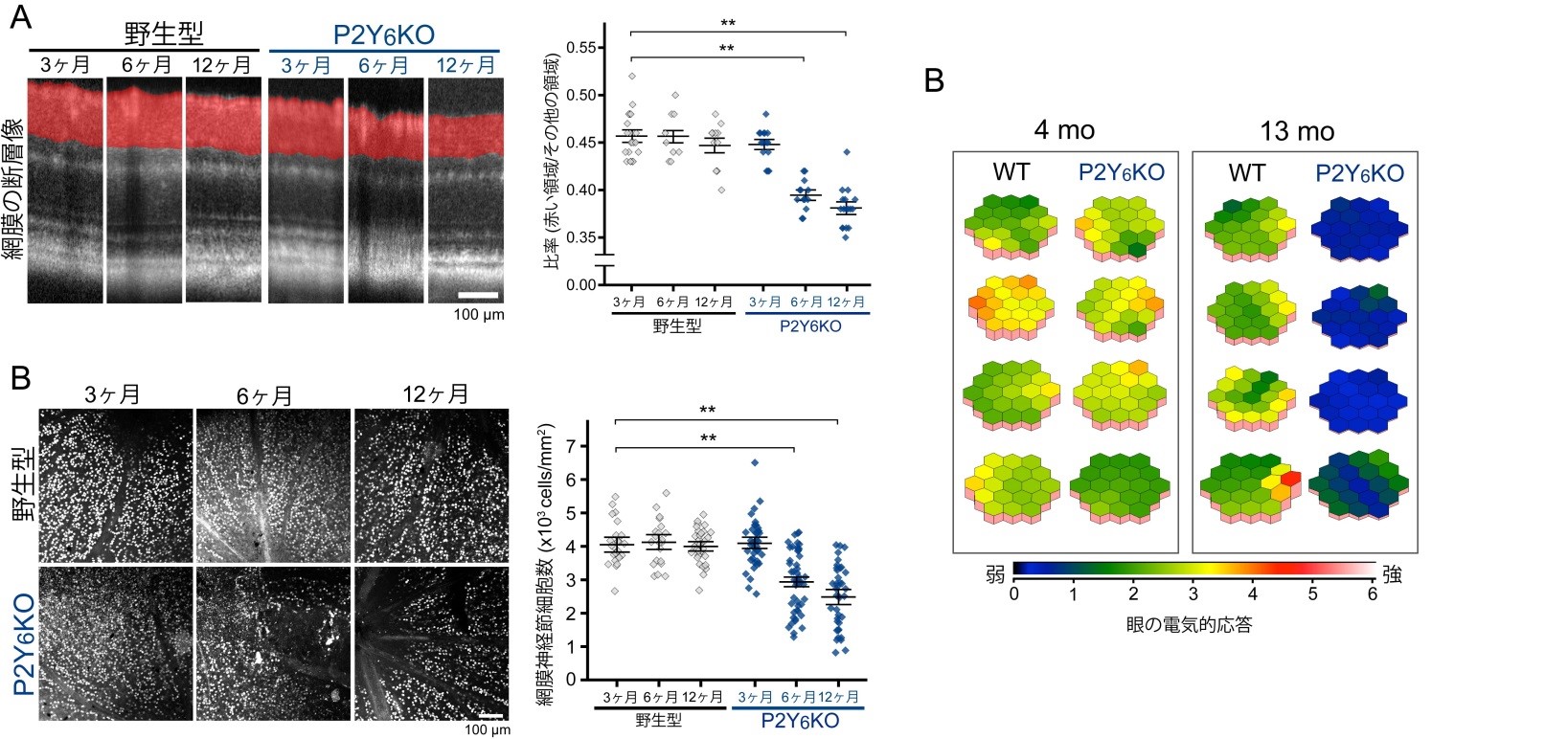
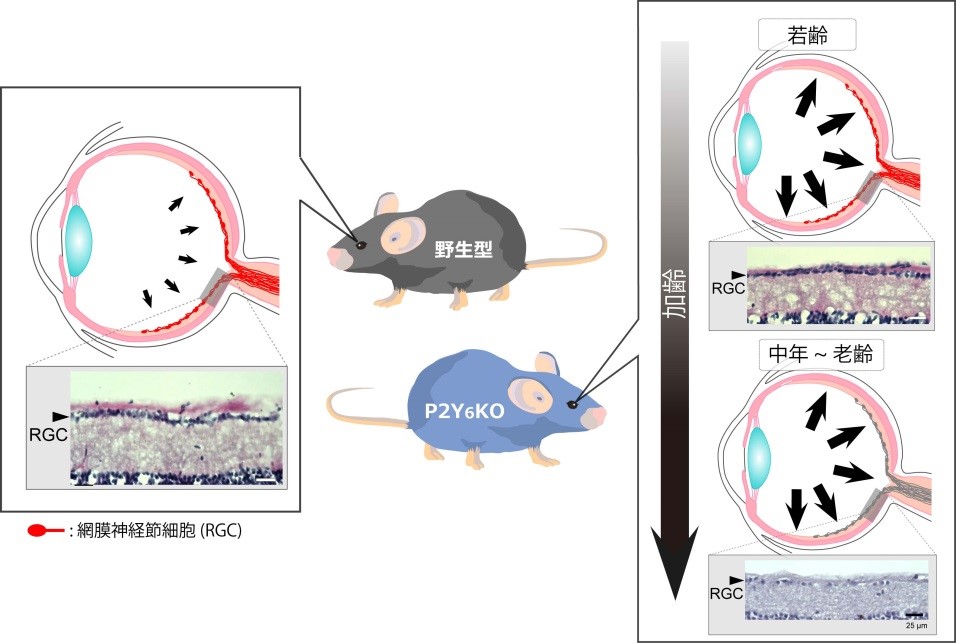
研究チームはまず、マウスの眼圧を低下させるヌクレオチドの探索を行いました。その結果、正常なマウス(野生型マウス)においてP2Y6受容体を選択的に活性化させるウリジン二リン酸(UDP)を点眼すると眼圧が低下する事を発見しました(図1)。UDPによる眼圧低下作用はP2Y6受容体を欠損したマウス(P2Y6KO)では見られませんでした。眼房水の動き(産生・排出)を評価する実験モデルとしてマウスに投与した蛍光分子が眼の前房へと経時的に移行する様子をモニタしたところ、UDPは蛍光分子の眼への移行を顕著に抑制しました(図2)。眼房水産生を抑制するチモロールによっても同様の反応が起きましたが、眼房水の排出を促進するラタノプロストでは起きませんでした。つまり、UDPの作用は眼房水の産生を抑制した結果起きたものと考えられました(図3)。P2Y6KOマウスでは野生型マウスに比べて眼への蛍光分子の移行が速く、恒常的に眼房水の産生が亢進している事が明らかとなりました(図4)。眼房水の産生及び排出のバランスが崩れると眼圧が変化するため、眼圧を計測したところP2Y6KOマウスの眼圧が顕著に高い事が明らかとなりました。慢性的な高眼圧は緑内障発症のリスクであるため、P2Y6KOマウスの眼の組織学的変化や視覚機能を調べました。野生型マウスでは週齢に関わらず網膜の菲薄化、網膜神経節細胞数並びに視覚機能に変化はありませんでした。P2Y6KOマウスでは若齢(3-4ヶ月齢)では顕著な異常は認められませんでしたが、加齢(6-13ヶ月齢)によって網膜の菲薄化、網膜神経節細胞数の減少そして視覚機能の低下が観察されました(図5)。これらの結果から、P2Y6受容体の欠損は加齢に伴う緑内障発症リスクを増加する事が明らかとなりました。さらに、P2Y6受容体は野生型マウスでも変化するか検討したところ、加齢に伴って発現が顕著に低下する事並びにUDPによる眼圧低下作用が減弱する事が明らかとなりました。以上の結果より、P2Y6受容体を欠損すると緑内障に関連する変化(眼圧上昇、網膜傷害、視覚機能低下)が観察され、緑内障発症リスクを上昇させる事が明らかとなりました。併せて、野生型マウスでも加齢によって顕著にP2Y6受容体発現や機能が低下する事から、この事が潜在的な緑内障発症リスクとなりうる可能性が考えられました。
本研究は、文部科学省の科学研究費補助金・新学術領域研究「グリアアセンブリの動作原理の解明」(研究代表者:小泉修一)、国立研究開発法人科学技術振興機構(JST)-戦略的創造研究推進事業(CREST)「非標識神経伝達物質イメージセンサによる可視化システム構築と脳機能の時空間解析」(分担研究者:小泉修一)、国立研究開発法人日本医療研究開発機構(AMED)-CREST「生体内シナプス長期再編におけるグリア−シナプス機能連関」(分担研究者:小泉修一)、新学術領域・学術研究支援基盤形成「先端バイオイメージング支援プラットフォーム」(被支援者:篠崎陽一、支援者:大野伸彦)、 物質・デバイス領域研究拠点(研究代表者:大野伸彦)、AMED「難治性疾患実用化研究事業」(研究代表者:岩田岳)、基盤研究(B)、基盤研究(C)、若手研究(B)、公益財団法人金原一郎記念医学医療振興財団及び公益財団法人武田科学振興財団による支援を受けて行われました。
今回の結果より、P2Y6受容体が眼圧を低下させる作用があることが明らかとなりました。従って、P2Y6受容体を効果的に活性化する、または発現を上昇させる薬剤が緑内障の治療ターゲットとして有望であると期待されます。
[1] 細胞外ヌクレオチド
細胞内にはエネルギーの元となるアデノシン三リン酸(ATP)が高濃度で存在します。このATPは様々な生理的な刺激や傷害などによって細胞外へと放出または漏出します。このような細胞外ヌクレオチドは細胞表面に存在するヌクレオチド受容体(P2受容体)に結合する事によって細胞間情報伝達物質として機能します。ATPの他にもADP, UTP, UDPなど様々な細胞外ヌクレオチドがP2受容体を介して情報を伝達する事が知られています。
[2] 受容体
細胞表面や細胞内部に存在し、細胞外の特定の物質と結合することによって細胞内に情報を伝えるタンパク質の総称。
[3] 緑内障
緑内障は、視神経に傷害が起こって視野が次第に欠損していく病気です。網膜の最表面に存在する網膜神経節細胞の軸索と呼ばれる線維が傷害され、徐々にこの細胞の機能が低下し、最後には死んでしまいます。この網膜神経節細胞は視覚情報を脳に伝える必須の細胞であるため、この細胞が傷害される事で視野が欠損すると考えられます。
[4] 有病率は40歳以上で5%
平成12年~13年に行われた日本緑内障学会多治見緑内障疫学調査(通称:多治見スタディ)による調査結果。それまで日本において緑内障の有病率を国際的に認められるレベルで科学的に算出された報告はありませんでした。本調査によって日本における緑内障の各年代における有病率が初めて明らかとなりました。
[5] 眼圧
眼圧は眼房水の産生及び排出のバランスによって眼内に生じる圧力の事です。眼圧が上昇すると視神経への機械的な負荷が増加し、それによって傷害されると考えられます。
[6] 眼房水
眼房水は眼の中を循環する液体で、眼の組織へ栄養分などを送ったり眼から老廃物を排出します。
各種ヌクレオチドを点眼し、眼圧の変化を検討したところウリジン二リン酸(UDP)が眼圧を低下させる事を発見しました。マウスに対して最大の効果を発揮する濃度は500マイクロモーラー(μM)でした。
(A)マウスに蛍光分子を投与し、眼球をCCDカメラで経時的に撮影し、蛍光強度の変化をモニタしました。(B)実際の画像。投与直後(0分)ではマウスの眼には蛍光分子が無いため暗いですが、投与後30分では蛍光分子の移行によって明るくなっています。(C)数値化したデータ。生理食塩水を投与した群(○)では30分後にスタート時より蛍光の強さが300%に上昇していました。UDPを点眼した群(●)ではその上昇率が顕著に抑制されていました。
眼房水は毛様体突起から産生され、線維柱帯網を通過してシュレム管やぶどう膜強膜経路などを経て排出されます。今回の結果ではUDP及びP2Y6受容体の作用は眼房水の産生を抑制すると考えられました。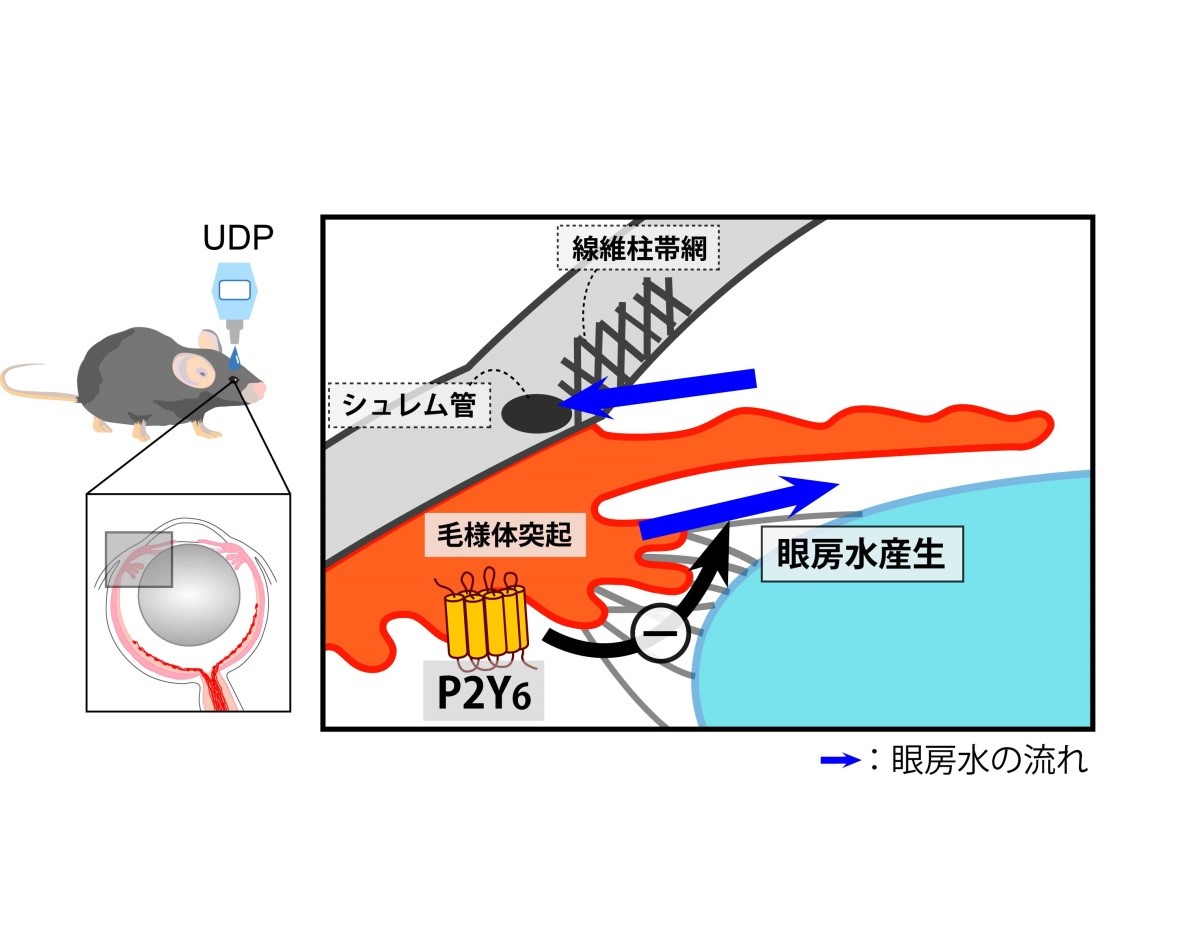
(A)P2Y6KOマウスでは蛍光分子の眼への移行速度が顕著に早く、眼房水の産生が過剰になっているとと考えられました。(B)眼圧を計測してみると、野生型マウスに比べてP2Y6KOマウスでは顕著に眼圧が高い事が明らかとなりました。
(A)光干渉断層計による網膜の観察。P2Y6KOマウスでは老化に伴って網膜神経節細胞を含む細胞層(赤い領域)が菲薄化する事が明らかとなりました。また、(B)網膜を平坦に展開したサンプルにおいてP2Y6KOマウスでは老化により網膜神経節細胞の数(写真中の白い点)が顕著に減少する事が明らかとなりました。(C)同様に、視覚機能に関連する眼の電気的応答も老化したP2Y6KOマウスでは著しく低下することが明らかとなりました。
本研究は、米国医学誌発行の『JCI Insight』に掲載されます (平成29年10月5日(木)午前9時(米国東部標準時間):日本時間10月5日(木)22時)。
(掲載URL: https://doi.org/10.1172/jci. insight.93456. )
*研究チーム
山梨大学大学院 総合研究部 医学域 基礎医学系 薬理学講座チーム
教授 小泉 修一
講師 篠崎 陽一 (筆頭著者)
大学院生 武田 明子
山梨大学大学院 総合研究部 医学域 臨床医学系 眼科学講座チーム
准教授 柏木 賢治
(公財)東京都医学総合研究所 視覚病態プロジェクトチーム
参事研究員 原田 高幸
副参事研究員 行方 和彦
生理学研究所 分子神経生理部門チーム
准教授 大野 伸彦 (現自治医科大学 医学部 解剖学講座)
Université Libre de Bruxelles Institute of Biology and Molecular Medicineチーム
Professor Bernard Robaye
国立病院機構東京医療センター 臨床研究センター 分子細胞生物学研究部チーム
部長 岩田 岳
Purinergic dysregulation causes hypertensive glaucoma-like optic neuropathy.
Youichi Shinozaki, Kenji Kashiwagi, Kazuhiko Namekata, Akiko Takeda, Nobuhiko Ohno, Bernard Robaye, Takayuki Harada, Takeshi Iwata & *Schuichi Koizumi *責任著者
JCI Insight 2017年10月5日(木)22時(日本時間) 掲載
<研究について>
国立大学法人 山梨大学 医学部
薬理学講座 教授 小泉 修一(コイズミ シュウイチ)
公益財団法人 東京都医学総合研究所 視覚病態プロジェクトチーム
参事研究員 原田 高幸(ハラダ タカユキ)
大学共同利用機関法人 自然科学研究機構 生理学研究所
分子神経生理部門チーム (現自治医科大学 医学部 解剖学講座)
准教授 大野 伸彦(オオノ ノブヒコ)
独立行政法人 国立病院機構 東京医療センター 臨床研究センター 分子細胞生物学研究部
部長 岩田 岳 (イワタ タケシ)
<広報に関すること>
国立大学法人 山梨大学
総務部総務課広報企画室
公益財団法人 東京都医学総合研究所 事務局 研究推進課
大学共同利用機関法人 自然科学研究機構 生理学研究所
研究力強化戦略室
独立行政法人 国立病院機構 東京医療センター 臨床研究センター 分子細胞生物学研究部
部長 岩田 岳 (イワタ タケシ)





山梨大学
(公財)東京都医学総合研究所
生理学研究所
国立病院機構東京医療センター