山梨大学医学部薬理学講座 小泉修一教授及び木下真直医員らの研究グループは、うつ病治療薬が、神経細胞以外の新しい標的細胞「アストロサイト」に作用して治療効果を発揮することを発見しました。慶應義塾大学医学部精神・神経科学教室 田中謙二准教授、生理学研究所 池中一裕教授、岡山大学 森山芳則教授(研究当時、現松本歯科大学)らが協力しました。これまで、うつ病治療薬として頻用されている選択的セロトニン再取り込み阻害薬[1]は、神経細胞に作用してその治療効果を発揮すると当たり前のように信じられてきました。しかし、今回マウスを使った実験により、うつ病治療薬がグリア細胞「アストロサイト[2]」に作用して、その治療効果を発揮することを示しました。また、アストロサイトに作用した後、抗うつ効果が発揮される分子メカニズムも明らかにしました。本研究により、不明点が多かったうつ病治療薬の新たな作用メカニズムと、さらにうつ病の原因におけるアストロサイトの役割が明らかになりました。グリア細胞を標的とした、新しいうつ病治療薬の開発が期待されます。
本研究成果は、CellとLancetの共同出版誌であるEBioMedicine誌に掲載されました。
論文タイトル:
Anti-depressant fluoxetine reveals its therapeutic effect via astrocytes
著者:
Manao Kinoshita, Yuri Hirayama, Kayoko Fujishita, Keisuke Shibata, Youichi Shinozaki, Eiji Shigetomi, Akiko Takeda, Ha Pham Ngoc Le, Hideaki Hayashi, Miki Hiasa, Yoshinori Moriyama, Kazuhiro Ikenaka, Kenji F. Tanaka and *Schuichi Koizumi *責任著者
雑誌名:EBioMedicine 2018年6月8日 オンライン掲載
掲載URL: http://www.ebiomedicine.com
うつ病は、有病率が5〜8%と高く、かつ若年での発症も多い疾患です。うつ病は患者のQOLを大きく低下させ、また自殺の大きな原因ともなるため、その社会的影響は大きく、うつ病の病態解明とより良い治療法の開発は医学的にも社会的にも切迫した課題です。
うつ病の病態としては、遺伝的素因やストレスなど環境因子により、セロトニンやノルアドレナリンといったモノアミンと呼ばれる神経伝達物質[3]が欠乏していることが分かっており、既存のうつ病治療薬のほとんどが、「モノアミン欠乏状態」を改善させることを目的に開発されてきました。しかしながら、既存の治療薬は治療効果が出るまでに時間がかかったり、効果が不十分であったり、副作用で悩まされる患者も多いのが現状です。うつ病の回復と関係する事象を正確に理解し、新たな治療戦略・治療法を確立することが急務であると言えます。
うつ病治療薬として頻用されている選択的セロトニン再取り込み阻害薬(SSRI)は、神経細胞の外に一度放出されたセロトニンが細胞内へ回収される「再取り込み」を阻害することにより、脳内のセロトニン量を増やします。これにより、神経伝達が改善され、うつ病の治療効果が現れると考えられてきました。 しかしながら、再取り込み阻害作用は薬剤投与開始後、速やかに起こる急性期の作用であるにもかかわらず、実際のうつ病の治療効果が認められるようになるのに2〜6週間程度かかるというタイムラグなどの矛盾があり、これだけでは薬剤の作用機序を十分に説明することは困難でした。そのため、別の薬理機序があると想定されていましたが、これまでその詳細は十分に明らかになっていませんでした。
脳内には神経細胞以外にもグリア細胞という細胞群が存在しますが、脳機能との関連性や、特にうつ病との関連性ではほとんど注目されていませんでした。グリア細胞の一種で、神経細胞の周囲に豊富に存在し、神経細胞の物理的支持、栄養供給などを行うアストロサイトは、近年、神経伝達や脳機能にも影響を及ぼすことが明らかになり、注目を集めています。
我々はうつ病治療薬がアストロサイトにも作用することで、うつ病の治療効果を発揮することを明らかにしました。
今回、研究チームは、代表的なうつ病治療薬であるSSRIのうち、フルオキセチンを用いて、アストロサイトに及ぼす影響を、マウスを用いた実験により詳細に解析しました。フルオキセチンはアストロサイトに作用すると、VNUT[4]と呼ばれる輸送体を介した機序によりATP[5]の細胞外への放出を促進しました。ATPやその分解産物であるアデノシン[6]は、さらにアストロサイトのATP受容体[7]やアデノシン受容体[8]に作用することで、BDNF[9]の発現を亢進させました。BDNFは神経の伸張、傷害からの修復、神経新生作用を有し、うつ病病態において障害された神経細胞を修復することでうつ病治療効果に繋がることが知られています。実際にアストロサイトからのATP放出を遺伝的に阻害したマウスでは、フロキセチン投与後にみられるアストロサイトのBDNF産生が消失し、フルオキセチンのうつ病治療効果が減弱しており、逆にアストロサイトからのATP放出を遺伝的に増幅させたマウスではうつ病治療効果が高まっていました。他のうつ病治療薬でも、同様の作用が認められたことから、今回認められた作用はフルオキセチンだけに特徴的なものではなく、抗うつ薬にある程度共通した性質であることが示唆されました。
これまで神経細胞への作用のみで説明づけられていた選択的セロトニン再取り込み阻害薬が、実は神経組織の支持細胞であるアストロサイトにも作用しており、アストロサイトでのBDNF産生機構が、既存のうつ病治療薬における、今まで知られていなかった作用機序として重要であることを解明しました。
本研究は、日本学術振興会 新学術領域研究「グリアアセンブリの動作原理の解明」(研究代表者:小泉修一教授)、新学術領域研究「MANネットワークの可視化と操作による脳情報動態学研究」(研究代表者:小泉修一教授)、新学術領域研究「グリアアセンブリによる脳機能発現の制御と病態」、基盤研究(B)、武田科学振興財団、倉田奨励金、高橋産業経済研究財団、先進医薬研究振興財団による支援を受けて行われました。
本研究によって、既存のうつ病治療薬の新たな作用機序として、今まで考えられてきた神経細胞への作用のみならず、アストロサイトにも作用することがうつ病治癒過程に重要であること、及びその分子メカニズムが明らかになりました。今後は、アストロサイトのうつ病治療作用に着目した薬物等を見出すことにより、アストロサイトの視点からうつ病の創薬開発を行ないたいと考えています。
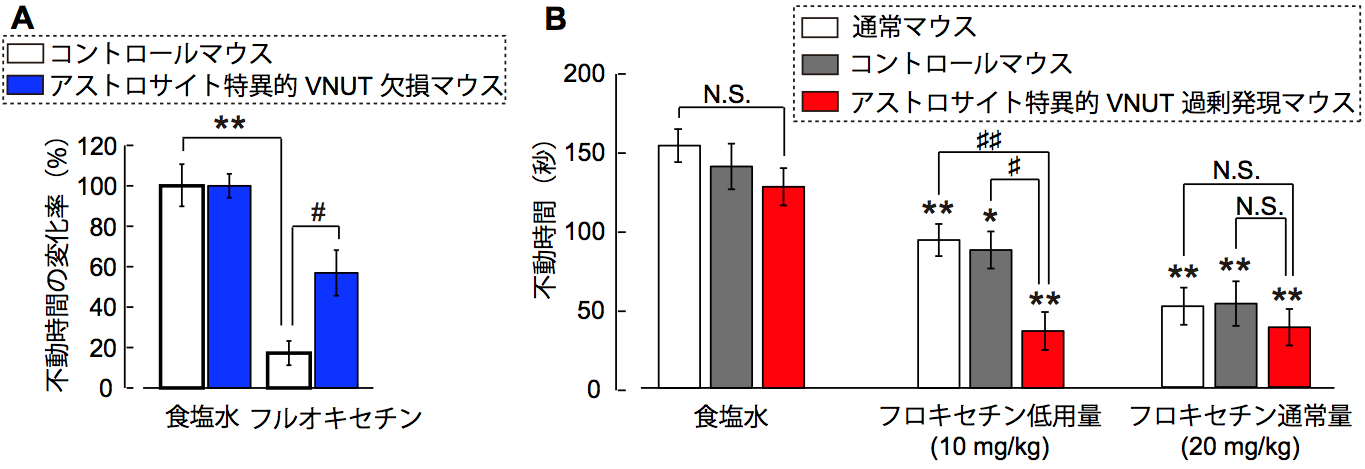 選択的セロトニン再取り込み阻害薬(フルオキセチン)を慢性投与したマウスの抗うつ効果を行動実験により計測したもの。不動時間が短いほど、抗うつ効果が高い。
選択的セロトニン再取り込み阻害薬(フルオキセチン)を慢性投与したマウスの抗うつ効果を行動実験により計測したもの。不動時間が短いほど、抗うつ効果が高い。
A. アストロサイト特異的にVNUTを欠損したマウスでは、フルオキセチンによる抗うつ効果が減弱していた。
B. アストロサイト特異的にVNUT発現を増幅したマウスでは、低用量のフルオキセチンでも高い抗うつ効果を示した。
このことから、フルオキセチンによる抗うつ効果は、アストロサイトにおけるVNUT発現と相関し、抗うつ効果におけるアストロサイトの重要性が示唆された。
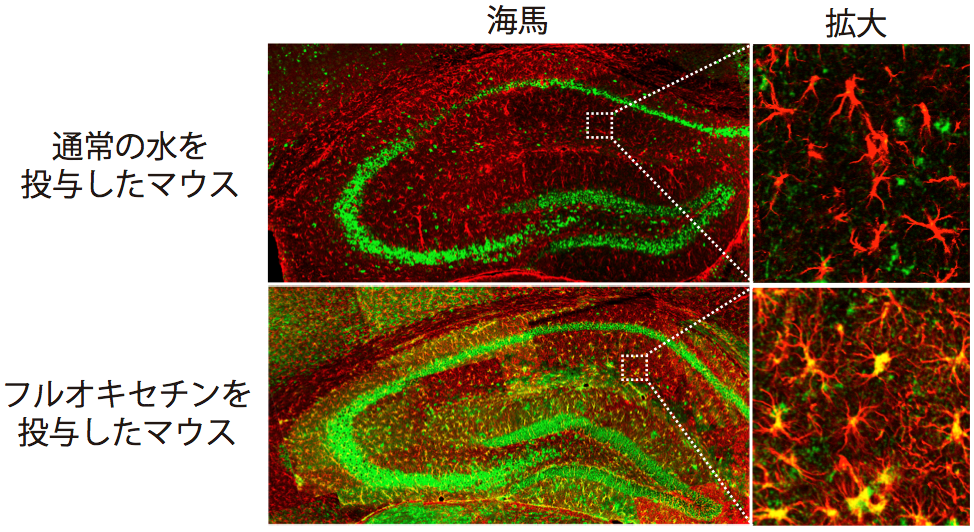 水、フルオキセチンを慢性投与後に、海馬組織を緑:BDNF、赤:アストロサイトマーカー(GFAP)で染色した。
水、フルオキセチンを慢性投与後に、海馬組織を緑:BDNF、赤:アストロサイトマーカー(GFAP)で染色した。
通常の水を投与したマウスの海馬では、BDNFは神経細胞層に帯状に発現しているが、アストロサイトには発現していない(上)。
一方、フルオキセチンを投与したマウスの海馬では神経細胞層でのBDNF発現も上昇しているが、赤色で染色されたアストロサイトでも強くBDNFを発現しているのが確認された(下)。
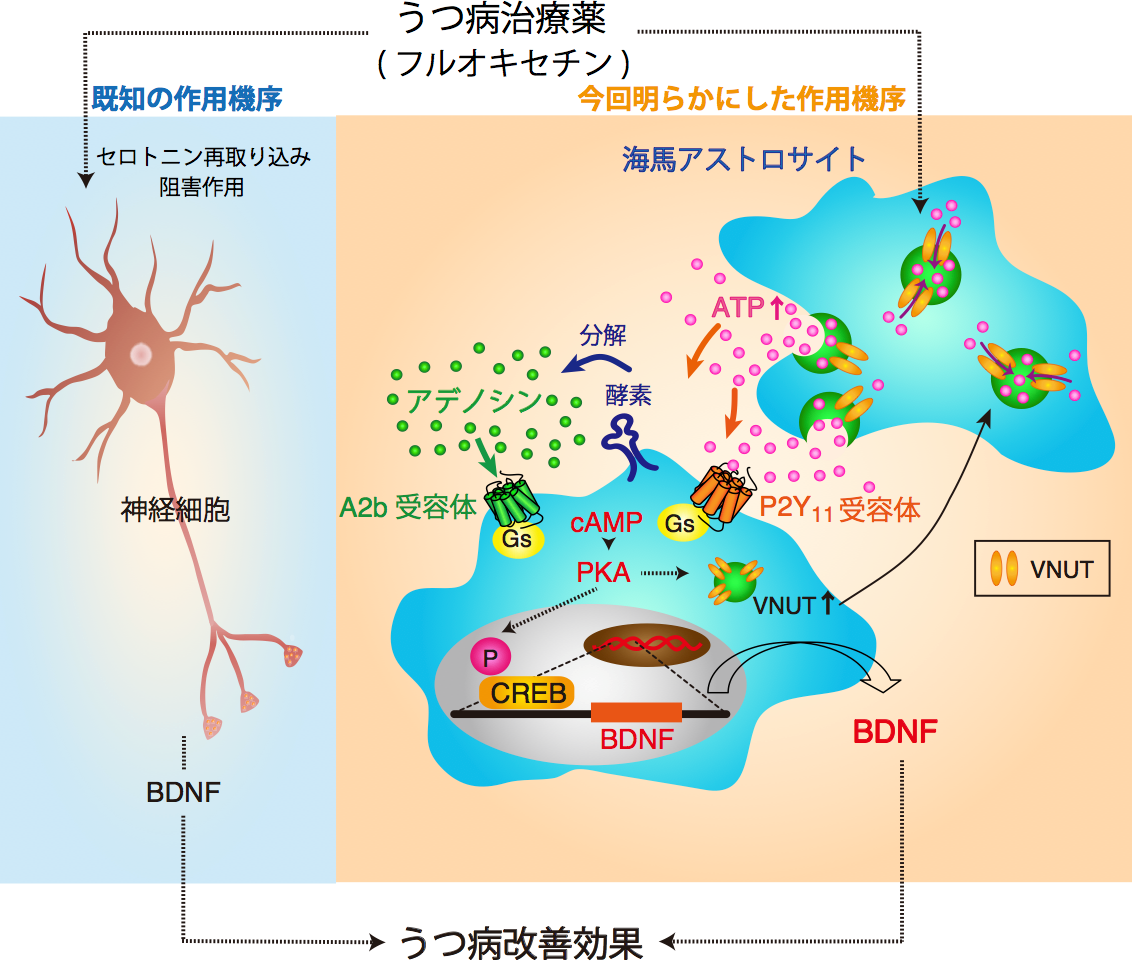
選択的セロトニン再取り込み阻害薬の薬理機序としてはこれまで、神経細胞におけるセロトニン再取り込み阻害作用による神経細胞からのBDNF発現がうつ病治療効果をもたらすと想定されていました(左)。
この研究により、選択的セロトニン再取り込み阻害薬(フルオキセチン)はアストロサイトにも作用することで、VNUTと呼ばれる小胞輸送体を用いたATP放出を誘導し、ATPとその分解産物であるアデノシンがそれぞれP2Y11受容体、A2b受容体に作用することで、cAMP、PKAを介したCREBリン酸化(転写因子活性化)の機序により、BDNFの産生が誘導され、うつ病改善効果を示していることが解明されました。
<研究に関する問合せ>
国立大学法人 山梨大学 医学部
薬理学講座 教授 小泉 修一(コイズミ シュウイチ)
<報道に関する問合せ>
国立大学法人 山梨大学 総務部総務課広報企画室




国立大学法人 山梨大学医学部
慶應義塾大学医学部
大学共同利用機関法人 自然科学研究機構 生理学研究所
国立大学法人 岡山大学
松本歯科大学