| 脳の再生医療の鍵を握るものとして注目される神経幹細胞。脳のすべての神経細胞・グリア細胞の源であり、私たち成人の脳にもあって、記憶の形成や気分の安定に重要だと考えられています。この神経幹細胞はどのように維持されているのでしょうか?今回、自然科学研究機構・生理学研究所の池中一裕教授と滋賀医科大学の等 誠司教授のグループは、エピゲノム修飾因子であるBre1a(ブレワンエー)が神経幹細胞の増殖と分化を制御していることを発見しました。脳腫瘍の1つであるグリオーマでも、この分子メカニズムが働いていると推定され、グリオーマの治療技術の進歩にも期待できる研究成果です。米国の神経科学誌(Journal of Neuroscience)(2月19日号)に掲載されました。 |
神経幹細胞は、胎児期の脳で大量の神経細胞・グリア細胞を産み出すとともに、自分自身を維持するように、増殖と分化のバランスをうまく調節する必要があります。増殖とは、すなわち、細胞分裂(1個の細胞が分裂して2つの細胞になる過程を細胞周期と呼びます)の積み重ねであり、1回の細胞周期にかかる時間が重要になってきます。神経幹細胞では、胎児期に細胞周期がどんどん伸びていき、成人の脳では遂に非常にゆっくりとしか分裂しなくなると考えられています。この”非常にゆっくりとしか分裂しない”という性質は、さまざまなタイプの幹細胞において、遺伝子変異のリスクを減らす(すなわち腫瘍化を防ぐ)という意義があるのだろうと、推測されています。
研究グループは、神経幹細胞の細胞周期と分化のバランスをとるために、両方を調節している因子があるはずだと考え、Bre1aという遺伝子を同定しました。Bre1aは、細胞のDNAが巻き付いているヒストンと呼ばれるタンパク質の1つ、H2Bをユビキチン化することが知られていました(図1)。最近、遺伝子の発現を調節する仕組みとして、エピゲノム修飾という言葉がしばしば使われ、世界中で研究のホットトピックスになっています。Bre1aによるヒストンH2Bのユビキチン化もエピゲノム修飾の1つで、細胞周期や分化に関わる多くの遺伝子群の発現を制御しているものと考えられます。
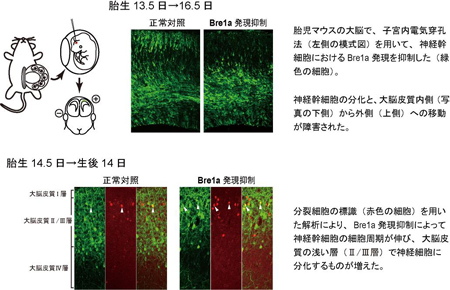
Bre1aは胎児期の脳の多くの細胞で発現していますが、ごく一部の細胞では発現低下しており、これらの細胞ではヒストンH2Bのユビキチン化も低下していました。そこで研究グループは、胎児期の神経幹細胞で人為的にBre1aの発現を低下させたところ、神経幹細胞の分化が抑制されることがわかりました。ここには、神経幹細胞の分化抑制に重要だと考えられている、Hes5(ヘス・ファイブ)という別の遺伝子の活性化が働いていることも、見出しました。同時に、Bre1aの発現が低下した神経幹細胞では、細胞周期が伸びて、分裂がゆっくりになっていることを、発見しました(図2)。
等教授は「神経幹細胞が安定して維持されるために、ヒストンH2Bのユビキチン化というエピゲノム修飾が関与していることを世界で初めて証明できた。脳腫瘍でも、グリオーマ幹細胞という腫瘍の元になる細胞の存在が、抗がん剤に対する抵抗性の原因の1つだと考えられている。グリオーマの治療戦略を考える際にも、この分子メカニズムが標的の1つとして重要だと推定される」と語っています。
本研究は文部科学省科学研究費補助金の補助を受けて行われました。また、三共生命科学研究振興財団(現・第一三共生命科学研究振興財団)およびアステラス病態代謝研究会からの研究助成金による支援を受けました。本研究は、東京大学・廣瀬謙造教授、基礎生物学研究所・藤森俊彦教授との共同研究の成果です。
1.経幹細胞では、Bre1a遺伝子の発現が低下しており、ヒストンH2Bのユビキチン化も低下していることを、明らかにしました。
2.経幹細胞で、Bre1aの発現が低下していることが、神経幹細胞の細胞周期をゆっくりにすることを発見しました。
3.同時に、Bre1aの発現低下によって、Hes5という別の遺伝子が活性化され、神経幹細胞の分化が抑制されることを確認しました。
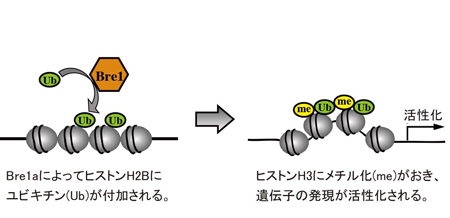 Bre1aは、DNAが巻き付いているヒストンと呼ばれるタンパク質の1つ、H2Bにユビキチンと呼ばれるタンパク質を付加します。その反応が引き金になり、隣のヒストンH3がメチル化され、近傍の遺伝子の発現が活性化されます。
Bre1aは、DNAが巻き付いているヒストンと呼ばれるタンパク質の1つ、H2Bにユビキチンと呼ばれるタンパク質を付加します。その反応が引き金になり、隣のヒストンH3がメチル化され、近傍の遺伝子の発現が活性化されます。
Bre1aをターゲットとした新しい脳腫瘍治療法の開発
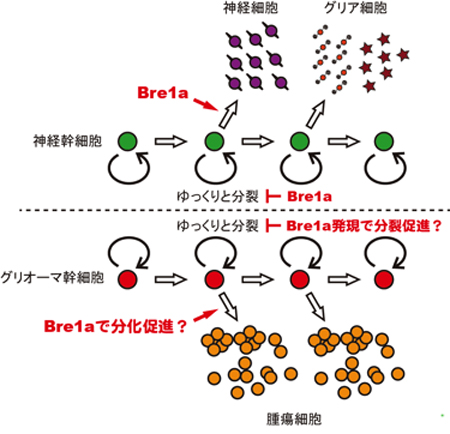
近年、激しく増殖する腫瘍の中には、ゆっくりとしか分裂しない”幹細胞”のような細胞がいることが明らかになっています。ゆっくりとしか分裂しないので、分裂細胞をターゲットにした放射線療法や化学療法に抵抗性で、がんの再発に関わっているのではないかと考えられています。脳腫瘍の1つであるグリオーマは、神経幹細胞に近い細胞ががん化したもので、グリオーマ”幹細胞”でもBre1aがその増殖と分化を制御している可能性があります(図3)。Bre1aを標的分子とした、脳腫瘍に対する新しい治療法の開発が期待されます。
Bre1a, a histone H2B ubiquitin ligase, regulates the cell cycle and differentiation of neural precursor cells
Yugo Ishino, Yoshitaka Hayashi, Masae Naruse, Koichi Tomita, Makoto Sanbo, Takahiro Fuchigami, Ryoji Fujiki, Kenzo Hirose, Yayoi Toyooka, Toshihiko Fujimori, Kazuhiro Ikenaka, and Seiji Hitoshi.
米国神経科学誌(Journal of Neuroscience)2014年2月19日発行
<研究について>
自然科学研究機構 生理学研究所 分子神経生理研究部門
教授 池中一裕 (いけなか かずひろ)
共同研究員 等 誠司 (ひとし せいじ)
滋賀医科大学 生理学講座 統合臓器生理学部門
教授 等 誠司 (ひとし せいじ)
<広報に関すること>
自然科学研究機構 生理学研究所 広報展開推進室