|
高血圧などの血行力学的負荷が心臓に加わり続けると、やがて心臓は硬化し、左心室の拡張機能障害を引き起こします。心臓が硬くなる原因として、心筋間質組織のコラーゲンの蓄積が知られていますが、力学的負荷によってコラーゲンが蓄積する機構は不明でした。今回、生理研の西田基宏教授(九州大学教授兼務)、北島直幸博士、冨田拓郎助教、渡辺雅彦教授(北海道大学)、佐藤陽治部長(国立医薬品食品衛生研究所)、住本英樹教授(九州大学)、桑原宏一郎教授(信州大学)、森泰生教授(京都大学)、米国国立環境衛生科学研究所らの共同研究グループは、心筋細胞膜に存在し、筋肉が持続的に伸展される刺激によって開閉するTRPC3チャネルが、コラーゲン線維の発現を誘導することを発見。これが心臓組織の線維化を誘発し、結果、心臓を硬くすることを発見しました。 本研究結果は、Nature publishing Groupが発行するScientific Reports誌に掲載されます(H28年12月19日午後7時オンライン版掲載)。 |
高血圧などの血行力学的負荷が心臓に加わり続けると、やがて心臓は硬化し、左心室の拡張機能障害を引き起こします。心臓が硬くなる原因として、心筋間質組織のコラーゲンの蓄積が知られていますが、力学的負荷によってコラーゲンが蓄積する機構は不明でした。今回、生理研の西田基宏教授(九州大学教授兼務)、北島直幸博士、冨田拓郎助教、渡辺雅彦教授(北海道大学)、佐藤陽治部長(国立医薬品食品衛生研究所)、住本英樹教授(九州大学)、桑原宏一郎教授(信州大学)、森泰生教授(京都大学)、米国国立環境衛生科学研究所らの共同研究グループは、心筋細胞膜に存在し、筋肉が持続的に伸展される刺激によって開閉するTRPC3チャネルが、コラーゲン線維の発現を誘導することを発見。これが心臓組織の線維化を誘発し、結果、心臓を硬くすることを発見しました。
本研究結果は、Nature publishing Groupが発行するScientific Reports誌に掲載されます(H28年12月19日午後7時オンライン版掲載)。
心臓は全身に血液を送り出すポンプとして非常に重要な役割を担っており、ポンプ機能の低下はすなわち心不全という病気を引き起こします。心不全患者の約50%近くが、左心室の収縮能力が保たれているにも関わらず弛緩能力が低下する「拡張機能障害を伴う心不全(HFpEF)」であることがわかっており、拡張機能障害の原因としてコラーゲン線維の蓄積に伴う心臓の硬化が示唆されています。心臓は、高血圧や大動脈狭窄など血行力学的に負荷が加わることで、代償的に肥大して自身のポンプ機能を維持しようとします。やがて、心筋が心臓に溜まった血液を十分に送り出せなくなってくると、今度は溜まった血液によって心筋が持続的に引っ張られます(容量負荷)。この容量負荷に適応すべく、心臓はコラーゲン産生を増加し、自身を硬くすることで高い収縮力を保とうとします。しかしその一方で、硬くなった心筋組織は十分に弛緩できなくなり、肺からの血液受け入れ能力(拡張機能)が低下し、やがて心不全を引き起こします。これを拡張機能障害といいます。拡張機能障害の原因としては、活性酸素が過剰に産生されることによってコラーゲン線維が蓄積するなどといったことが昔から指摘されていましたが、高血圧などの力学的負荷によって心臓が活性酸素を生成する機構についてはよくわかっていませんでした。
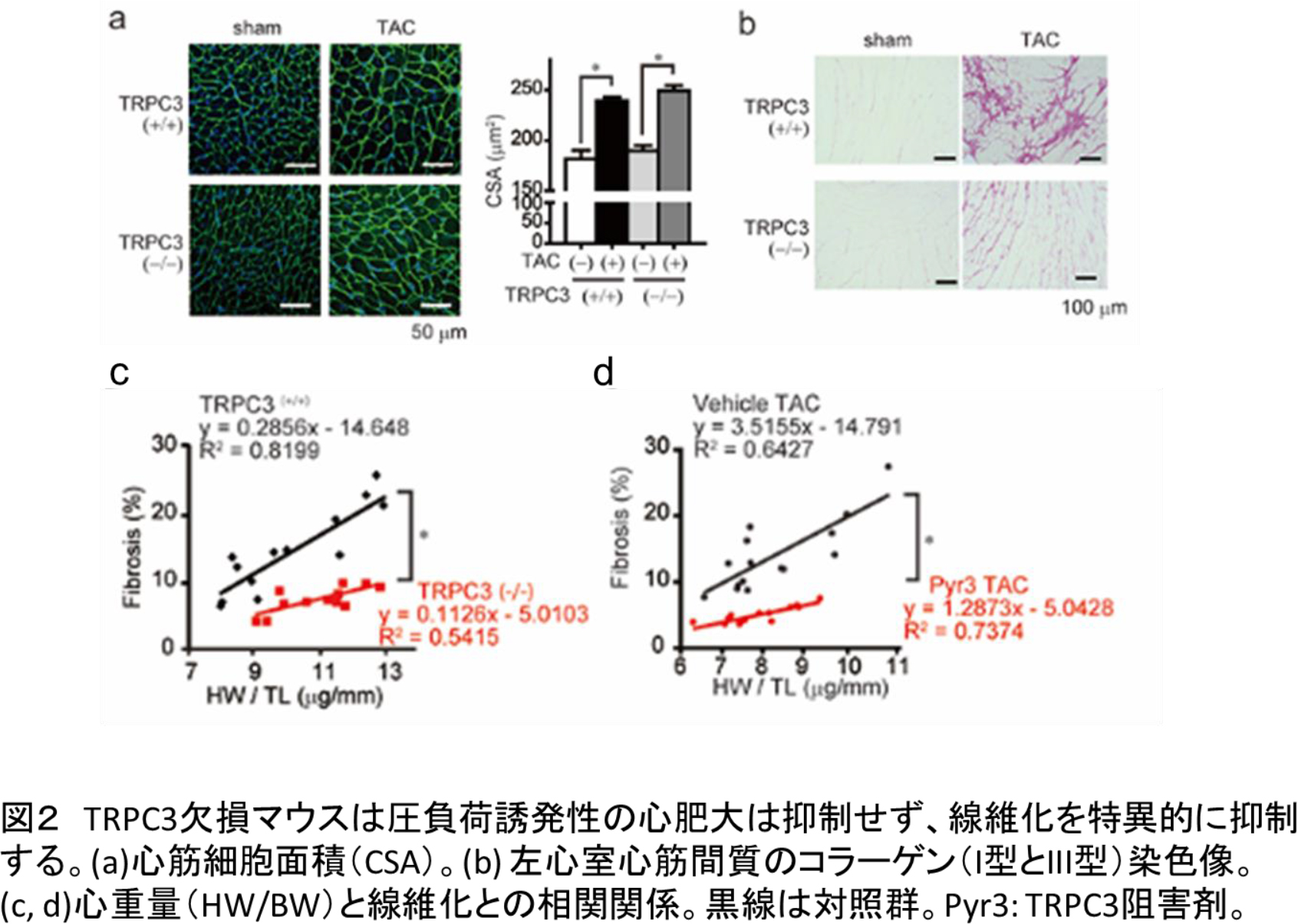
我々の研究グループは、心筋細胞膜上に存在するCa2+透過型カチオンチャネル(transient receptor potential canonical (TRPC) 3)を欠損させたマウスに大動脈狭窄を施し、高血圧と同様の圧負荷を与えたところ、圧負荷による心肥大は起こるものの、心臓の硬化と心機能不全(心不全)がほぼ完全に抑制されることを見出しました。通常、心不全マウスの心臓では酸化ストレスマーカーの発現量が顕著に増大します。ところが、TRPC3を欠損させたマウスの肥大した心臓では、酸化ストレスマーカーの発現はほとんど観察されませんでした。
そこで、酸化ストレスの原因となる活性酸素の生成酵素であるNADPHオキシダーゼという細胞膜タンパク質に着目したところ、TRPC3はNADPHオキシダーゼ2(Nox2)と相互作用し、Nox2タンパク質を安定化していることを明らかにしました。さらにTRPC3チャネルは心筋細胞が機械的に伸展された際に活性化し、Nox2を特異的に活性化することも明らかにしました。実際に、TRPC3とNox2の結合に必要なTRPC3チャネルを心筋細胞に発現させることで、TRPC3チャネルの活性化に依存した活性酸素の生成が増加することも確認されました。
以上の結果から、TRPC3チャネルはNox2の安定化と活性化を促進することで活性酸素シグナルを正に制御する役割を担うことが初めて明らかになりました。
本研究により、TRPC3チャネルが圧負荷誘発性の拡張機能障害を誘発する分子基盤がマウスレベルで明らかになりました。今後、TRPC3チャネル活性あるいはTRPC3-Nox2相互作用を阻害する化合物の探索が「心臓の硬化」を防ぐ新たな治療薬の開発につながると期待されます。
本研究は国立研究開発法人科学技術振興機構(JST)・戦略的創造研究推進事業(さきがけ)の研究領域「疾患における代謝産物の解析および代謝制御に基づく革新的医療基盤技術の創出」における研究開発課題「硫黄循環・代謝を基軸とした生体レドックス恒常性制御基盤の構築」(代表:西田 基宏教授)の一環で行われ、日本学術振興会の科学研究費補助金、文部科学省の新学術領域「酸素生物学」ならびに「包括型脳科学研究推進支援ネットワーク」、内藤記念財団、大幸財団などの研究助成による支援を受けて行われました。
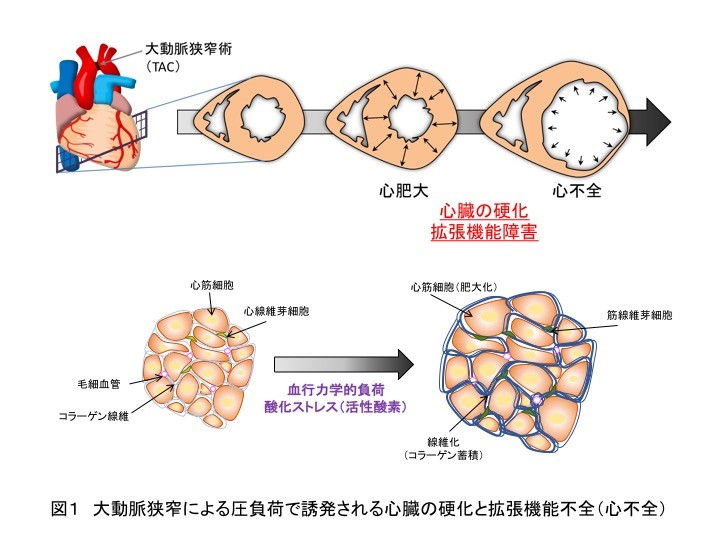
心臓から血液が出て行く出口(横行大動脈)を狭く(狭窄)すると、心臓に圧負荷がかかります。この圧負荷に打ち勝つべく、心筋は自身の筋肉量を増大することで適応しようとします(心肥大)。しかし、圧負荷が持続し、心筋が心臓に溜まった血液を十分に送り出せなくなると、溜まった血液によって心筋は持続的に引っ張られます(容量負荷)。この容量負荷に適応すべく、心臓はコラーゲン産生を増加し、自身を硬くすることで高い収縮力を保とうとします。しかし一方で、硬くなった心筋組織は十分に弛緩できなくなり、ポンプの重要な血液受け入れ能(拡張機能)が低下し、やがて心不全を引き起こします。
 TRPC3チャネルタンパク質は、心筋細胞が持続的に引っ張られることで活性化されるだけでなく、この引っ張られる刺激を受けて増加することが知られています。増加したTRPC3タンパク質は、心筋の細胞膜上で活性酸素を生成する酵素タンパク質であるNADPHオキシダーゼ(Nox2)と結合します。このNox2は、単体だと細胞内で速やかに分解されるとても不安定なタンパク質ですが、TRPC3とくっつき、複合体となることで安定します。そしてTRPC3もまたNox2と結合することで、心筋の細胞膜上に安定して発現することができるようになります。
TRPC3チャネルタンパク質は、心筋細胞が持続的に引っ張られることで活性化されるだけでなく、この引っ張られる刺激を受けて増加することが知られています。増加したTRPC3タンパク質は、心筋の細胞膜上で活性酸素を生成する酵素タンパク質であるNADPHオキシダーゼ(Nox2)と結合します。このNox2は、単体だと細胞内で速やかに分解されるとても不安定なタンパク質ですが、TRPC3とくっつき、複合体となることで安定します。そしてTRPC3もまたNox2と結合することで、心筋の細胞膜上に安定して発現することができるようになります。
心筋細胞膜が引っ張られるとTRPC3チャネルが開き、カルシウムイオン(Ca2+)が細胞外から細胞内に向かって流れこみます。流入したCa2+がNox2を活性化し、活性酸素が生成されることにより、酸化ストレスが誘発されるのです。
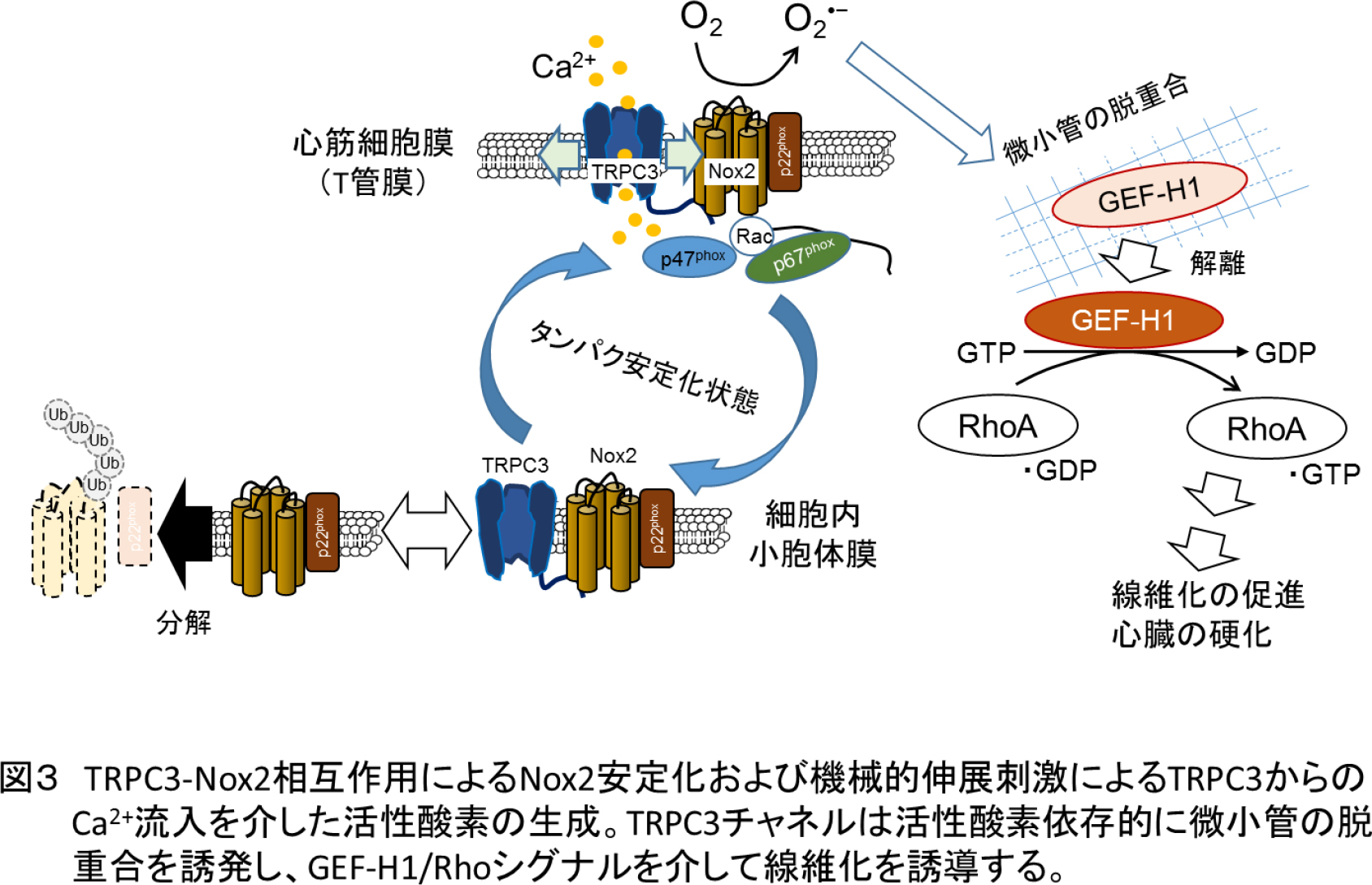
本研究成果では、TRPC3チャネルがどのようにして心筋細胞が持続的に引っ張られる刺激から心臓の硬化(線維化)を引き起こすのか、そのメカニズムを世界で初めて証明しました。これまでイオンチャネルをターゲットとした薬の多くは、細胞の電気的な活動をコントロールすることを目的としたものばかりでした。しかし今回の研究では、TRPC3チャネルと心臓の筋肉の線維化という、形態的な構造変化との直接的な関係性を示すことができたことから、HFpEFに有効な、新しいタイプの心不全治療薬開発の戦略構築が期待できます。
TRPC3 positively regulates reactive oxygen species driving maladaptive cardiac remodeling
Naoyuki Kitajima, Takuro Numaga-Tomita, Masahiko Watanabe, Takuya Kuroda, Akiyuki Nishimura, Kei Miyano, Satoshi Yasuda, Koichiro Kuwahara, Yoji Sato, Tomomi Ide, Lutz Birnbaumer, Hideki Sumimoto, Yasuo Mori, Motohiro Nishida
Sci. Rep. 6, 37001; doi: 10.1038/srep37001 (2016).
2016年11月11日オンライン掲載
TRPC3-GEF-H1 axis mediates pressure overload-induced cardiac fibrosis. Numaga-Tomita, T. Naoyuki Kitajima, Takuya Kuroda, Akiyuki Nishimura, Kei Miyano, Satoshi Yasuda, Koichiro Kuwahara, Yoji Sato, Tomomi Ide, Lutz Birnbaumer, Hideki Sumimoto, Yasuo Mori, Motohiro Nishida
Sci. Rep. 6, 39383; doi: 10.1038/srep39383 (2016).
2016年12月19日オンライン掲載
<研究について>
大学共同利用機関法人 自然科学研究機構 生理学研究所
心循環シグナル研究部門
大学法人 九州大学 大学院薬学研究院 創薬育薬研究施設統括室(併任)
教授 西田 基宏(ニシダ モトヒロ)
<広報に関すること>
大学共同利用機関法人 自然科学研究機構 生理学研究所
研究力強化戦略室
九州大学広報室
信州大学医学部庶務係
京都大学企画・情報部広報課国際広報室
今羽右左 デイヴィッド 甫
北海道大学総務企画部広報課
広報・渉外担当
国立医薬品食品衛生研究所 再生・細胞医療製品部
佐藤陽治






自然科学研究機構 生理学研究所 研究力強化戦略室
国立大学法人九州大学
国立大学法人信州大学
国立大学法人京都大学
国立大学法人北海道大学
国立医薬品食品衛生研究所