山梨大学医学部薬理学講座 小泉修一教授及び篠崎陽一講師の研究チームは、慶應義塾大学医学部精神・神経科学教室 田中謙二准教授、生理学研究所 分子神経生理研究部門 池中一裕教授のチームと共同で、マウスを使った実験によって脳内の「グリア細胞[1]」と呼ばれる細胞群が、外傷性脳損傷(Traumatic Brain Injury、以下TBI) から脳を保護する仕組みを明らかとしました。脳には複数種類のグリア細胞がありますが、そのうち先ず「ミクログリア」がTBIを感知し、その情報を「アストロサイト」に伝えることで、脳を保護するメカニズムが働きます。またこれら異なるグリア間での協調的な脳保護作用の分子メカニズムとして「グリア伝達物質[2]受容体[3]」の発現低下が必須であることを発見しました。
外傷性脳損傷(TBI)は、外傷による死亡原因の30%を占め、患者数は米国で約530万人、EUで770万人と推定されています。また一命をとりとめた場合にも、TBIは様々な脳機能障害、例えば認知機能障害、精神障害、種々神経変性疾患等の原因となる事が報告されており、大きな社会問題となっています。これらの背景から、TBIから脳を保護する分子メカニズムの解明は重要な課題の1つと言えます。
脳には、電気的興奮性により素早い情報発信・処理を行う「神経細胞」の他に「グリア細胞」と呼ばれる細胞群が存在します。グリア細胞は「ミクログリア[4]」「アストロサイト[5]」等の複数のグリア細胞から構成されていますが、最近の研究ではこれらグリア細胞もまた、脳の情報処理・発信に関係していることが明らかにされています。特にグリア細胞は、種々の脳疾患に応答してその性質を変化させることから、各種脳疾患時の情報処理・発信に重要であると考えられており、現在その重要性に大きな注目が集まっています。TBIによる神経傷害は、(1)物理的傷害による直接作用(一次的な傷害)、(2)神経炎症などによる傷害(二次的な傷害)、によって誘導されると考えられています。TBIによる二次性の神経傷害が問題となっていましたが、その詳細な分子メカニズムはこれまで不明のままでした。
研究チームはマウス大脳皮質のTBIモデルを使って、ミクログリア及びアストロサイトの応答を詳細に検討しました。TBIにより、(1)先ずミクログリアがTBIを感知して活性化型になること、(2)ミクログリアの情報を受け取ったアストロサイトが反応性型(反応性アストロサイト[6])に変化すること、(3)反応性アストロサイトは脳保護型であること、が明らかとなりました。TBIを最初に感知したミクログリアは、活性化して炎症性サイトカイン[7]と呼ばれる分子を産生し、これによりアストロサイトにTBIのその情報を伝え、反応性アストロサイトへの変身を誘導していました (図1)。ミクログリアから情報を受け取ったアストロサイトは、自身のP2Y1受容体[8]の発現及び機能を低下させることで神経保護型の反応性アストロサイトになり、突起を延ばして血球細胞の浸潤を防ぐことにより神経細胞をさらなる傷害から保護する事が明らかとなりました。このように、TBIに対し、ミクログリアとアストロサイトは、異なるタイミングで異なる応答性を示しますが、両者の巧妙かつ積極的なコミュニケーションによって、最終的にはTBIから神経細胞を保護する性質を獲得することがわかりました。この一連の応答の中で、最も重要と考えられる分子生物学的な応答が、アストロサイトのP2Y1受容体の発現及び機能が低下することでした。そこでin vitro(試験管レベルの研究)培養アストロサイトを用いてP2Y1受容体を薬理学的又は分子生物学的に抑制したところ、アストロサイトの反応性(神経保護作用)が顕著に増大する事が明らかとなりました。さらに、in vivo (動物個体レベルでの研究)でアストロサイトにおけるP2Y1受容体の役割をより明確にするために、アストロサイト特異的にP2Y1受容体を過剰発現または欠損した遺伝子改変マウスを作成して検討を行いました。アストロサイト特異的にP2Y1受容体を欠損させたマウスでは、アストロサイトの反応性及びTBIに対する神経保護作用が増大したのに対し、アストロサイト特異的にP2Y1受容体を過剰発現させたマウスでは、アストロサイトの反応性及びTBIに対する脳保護作用が低下しました(図2)。神経保護型の反応性アストロサイトは、瘢痕様の構造[9]を作ることで、外部からの不要分子の浸潤を防ぎ、の神経保護作用を示すことも明らかとなりました。
本研究は、文部科学省の科学研究費補助金・新学術領域研究「グリアアセンブリの動作原理の解明」(研究代表者:小泉修一)、基盤研究(B)、挑戦的萌芽研究、AMED、CREST, 若手研究(B)、及び公益財団法人 上原記念生命科学財団による支援を受けて行われました。
今回の結果より、TBIから脳を保護するためにグリア細胞が非常に重要な役割を果たしていることが明らかとなりました。特に、アストロサイトのP2Y1受容体の機能/発現を低下させて脳保護型の反応性アストロサイトを誘導することが重要であることが明らかとなりました。従って、外傷性脳損傷、特に二次性の脳損傷から脳を保護する戦略として、アストロサイトに介入すること、つまり、アストロサイトのP2Y1受容体をコントロールすることの有用性が期待されます。
[1] グリア細胞
脳などの中枢神経系を構成する細胞の1種。神経細胞よりも数が多い。グリア細胞は、神経細胞のように電気生理的な興奮性を示さないので、静的で活動しない細胞と考えられて来たが、他の新しい指標、例えばCa2+興奮性等で観察すると、非常に活発に活動している細胞であることが明らかとなり、最近特に注目されている細胞である。グリア細胞にはアストロサイト、ミクログリア、オリゴデンドロサイトやNG2陽性グリア細胞などが含まれる。
[2] グリア伝達物質
神経細胞間の繋ぎ目であるシナプス(化学シナプス)では、神経伝達物質と呼ばれる化学物質が放出され、情報が伝達される。これに対して、グリア細胞同士やグリア-神経間では、グリア伝達物質と呼ばれる化学物質が放出され、その情報が伝達される。グリア伝達物質の代表的な分子の1つがアデノシン三リン酸(ATP)である。
[3] 受容体
細胞表面や細胞内部に存在し、細胞外の特定の物質と結合することによって細胞内に情報を伝えるタンパク質の総称。
[4] ミクログリア
グリア細胞の1種で脳内における免疫担当細胞。正常状態では、突起を周囲に伸ばして周辺環境を常に監視しており、微小な環境変化を検知するといち早くその性質を変化させる。脳内の不要物の除去、神経細胞の修復などその機能は多岐に渡る。
[5] アストロサイト
グリア細胞の1種。最も大きく、数も多い。これまでは脳内の支持及び恒常性維持の役割を担うと考えられて来たが、最近は脳の情報処理にも積極的に関与する事が明らかとなっている。
[6] 反応性アストロサイト
アストロサイトは様々な刺激に応じてその性質を変化させる。特に反応性が増強した状態を反応性アストロサイトと呼ぶ。肥大化した突起及び細胞体や細胞マーカーであるグリア細胞繊維性酸性タンパク質(GFAP)の発現量増加などがその特徴として挙げられる。
[7] 炎症性サイトカイン
生体内における様々な炎症症状を惹起するタンパク質の総称。インターロイキン1(IL-1)やインターロイキン6(IL-6)、腫瘍壊死因子α(TNFα)などが代表的なものとしてよく知られている。
[8] P2Y1受容体
細胞外に放出または漏出したヌクレオチドに対する受容体(P2受容体)の1種。ATP及びその代謝物 (ADP)を感知して活性化する。
[9] アストロサイト瘢痕
TBI、脊髄損傷や脳梗塞など、神経系の一部が強く傷害されるとその周囲に存在するアストロサイトが応答して反応性アストロサイトとなり傷害部位を取り囲む構造を形成する。これをアストロサイト瘢痕と呼ぶ。従来は神経再生を阻害する邪魔者と考えられてきたが、傷害急性期における正常組織のバリア機能や回復期の神経細胞の足場として機能する事が明らかとなっている。
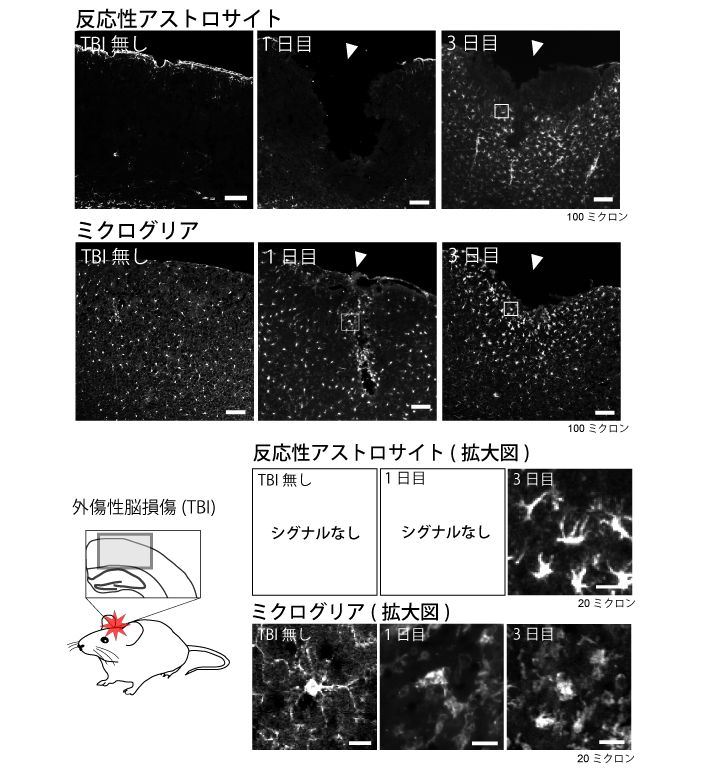
図1. ミクログリアはアストロサイトに先行して活性化する
反応性アストロサイトのシグナルは傷害の無い大脳皮質または傷害後1日目の大脳皮質では観察されず、傷害後3日目で観察されました。一方、ミクログリアは傷害後1日目で傷害中心部(矢印)において既に突起が退縮した活性化を示す形態に変化していました。
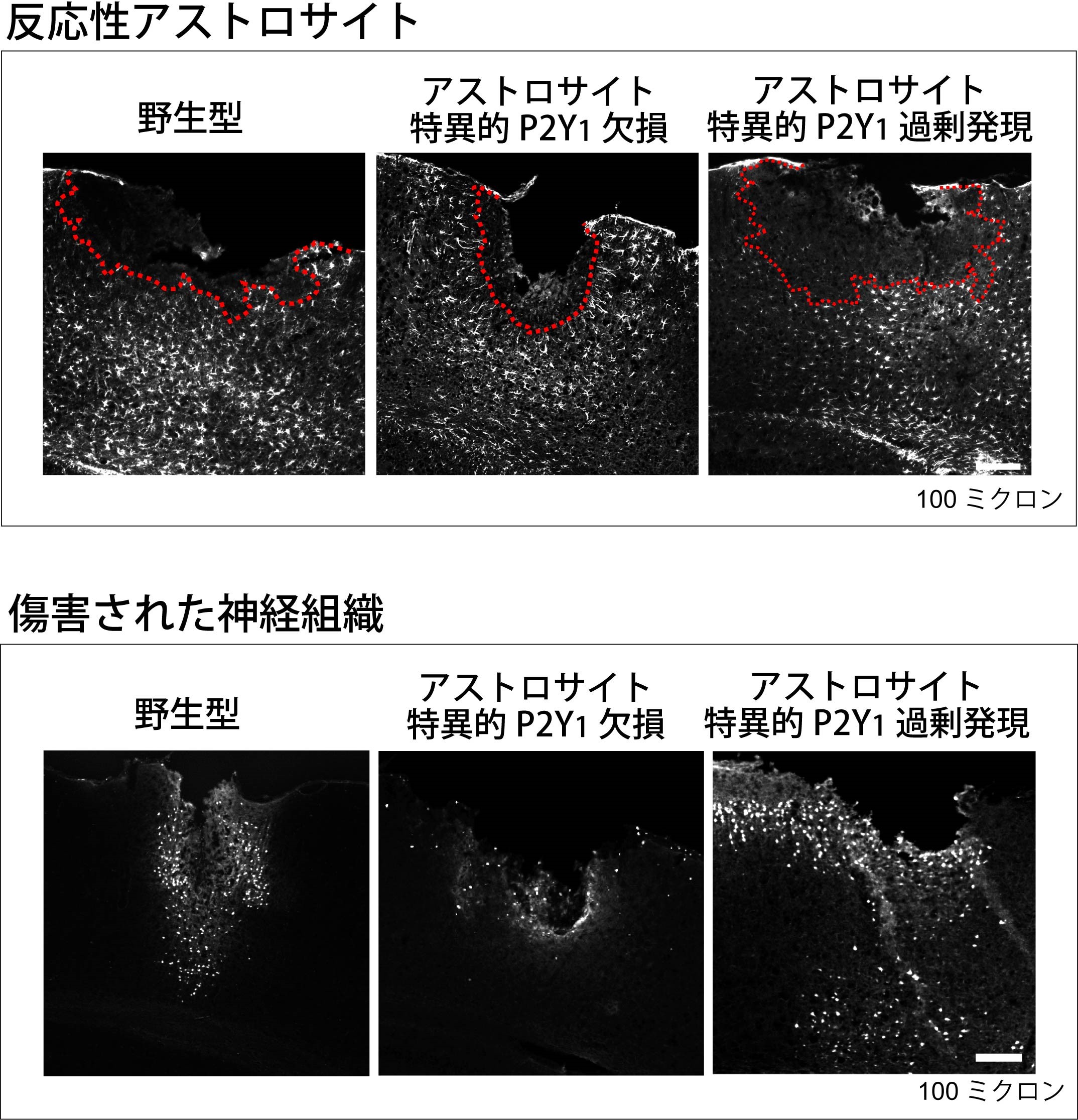
図2. アストロサイト特異的なP2Y1受容体欠損マウスはTBI後の神経組織傷害が軽減される
アストロサイト特異的にP2Y1受容体を欠損するマウスにTBIを与えたところ、野生型マウスに比べて顕著に反応性アストロサイト(上図に白色で表示)で取り囲まれた傷害部位(上図に赤い点線で表示)が顕著に縮小していました。これに伴って、神経組織の傷害(下図に白色で表示)は顕著に軽減していました。一方、アストロサイト特異的にP2Y1受容体を過剰発現するマウスでは傷害部位の領域及び神経組織の傷害が増悪しました。
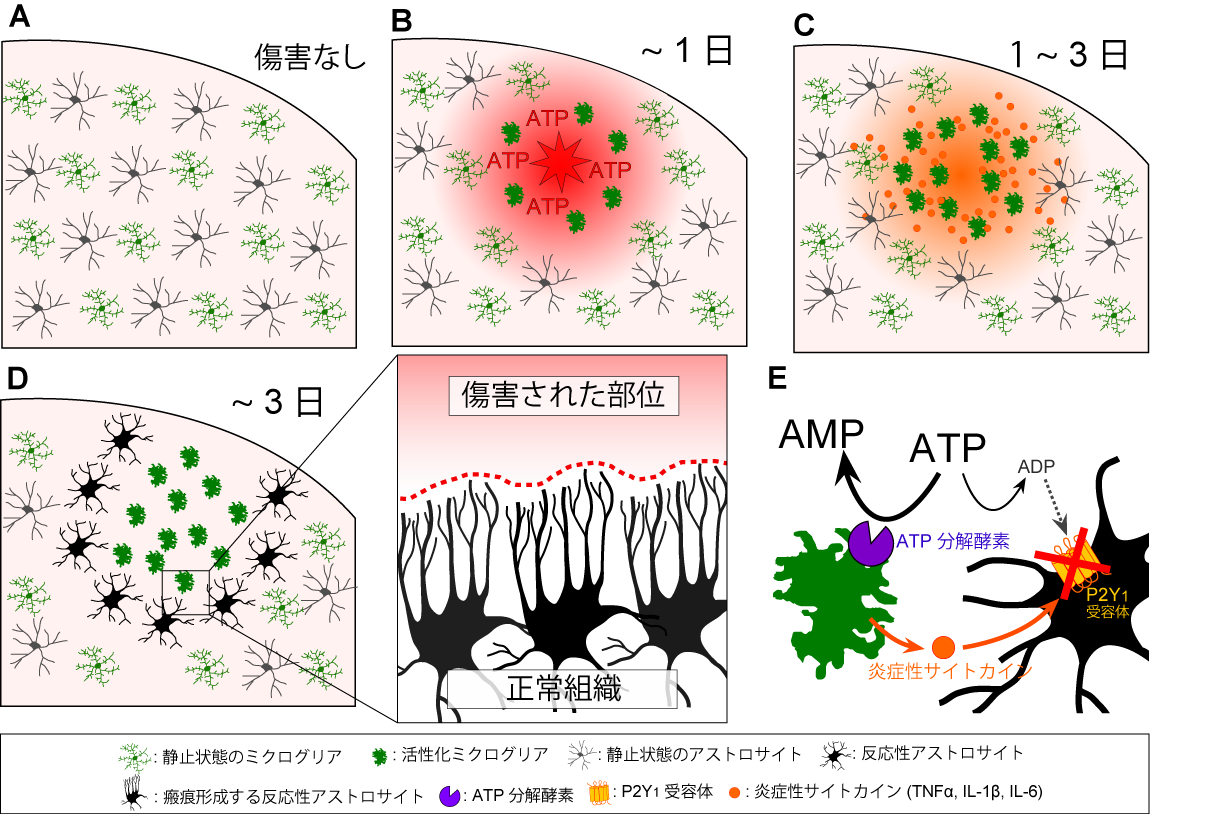
図3. 今回の発見内容の模式図
B. 脳傷害後の急性期に傷害部位からATPが放出・漏出し、これによりミクログリアが活性化します。C. 活性化したミクログリアは炎症性サイトカインを放出し、周囲のアストロサイトにその情報を伝えます。D 及びE. ミクログリアから情報を受け取ったアストロサイトは、P2Y1受容体の発現を低下させることで、脳保護型の反応性アストロサイトに変身します。この反応性アストロサイトは、突起を延ばす等の運動性を亢進させ、グリア瘢痕様の構造を形成し、TBIの二次性の神経傷害に対して保護的な作用を示します(Dの拡大部分)。
本研究は、米国科学雑誌『Cell Reports』に掲載されるのに先立ち、オンライン版(5月9日付け:日本時間5月10日(水)午前1時)に掲載されます。
(掲載URL: http://cellreports.cell.com%3Chttp://cellreports.cell.com/)
*研究チーム
国立大学法人山梨大学 医学部薬理学講座チーム
教授 小泉 修一
講師 篠崎 陽一 (筆頭著者)
助教 繁冨 英治
助教 柴田 圭輔
慶應大学 医学部 精神・神経科学教室チーム
准教授 田中 謙二
大学院生 吉田 慶多朗
大学共同利用機関法人自然科学研究機構生理学研究所 分子神経生理研究部門チーム
教授 池中 一裕
Transformation of neuroprotective astrocytes by microglia via P2Y1 receptor down-regulation.
Youichi Shinozaki, Keisuke Shibata, Keitaro Yoshida, Eiji Shigetomi, Christian Gachet, Kazuhiro Ikenaka, Kenji F Tanaka & *Schuichi Koizumi *責任著者
Cell Reports 2017年5月10日 掲載
<研究について>
国立大学法人 山梨大学 医学部
薬理学講座 教授 小泉 修一(コイズミ シュウイチ)
慶應大学 医学部 精神・神経科学教室チーム
准教授 田中 謙二(タナカ ケンジ)
大学共同利用機関法人自然科学研究機構生理学研究所 分子神経生理研究部門チーム
教授 池中 一裕(イケナカ カズヒロ)
<広報に関すること>
国立大学法人 山梨大学
総務部総務課広報企画室
慶應義塾大学 信濃町キャンパス総務課 広報担当
大学共同利用機関法人 自然科学研究機構 生理学研究所
研究力強化戦略室



国立大学法人 山梨大学
慶應義塾大学医学部
大学共同利用機関法人自然科学研究機構 生理学研究所