山梨大学医学部薬理学講座 小泉修一教授及び森澤陽介研究員 (研究当時、現東北大学助教) らの研究グループは、生理学研究所 鍋倉淳一教授、大野伸彦准教授 (現自治医科大学)、慶應義塾大学医学部 岡野栄之教授、新潟大学大学院医歯学総合研究科 竹林浩秀教授、群馬大学生体調節研究所 佐藤幸市准教授とのチームと共同で、マウスを使った実験によって、脳卒中(脳梗塞)による傷害後期に、これまでおとなしい神経組織の支持細胞と考えられてきた「グリア細胞[1]」の一種、アストロサイト[2]が貪食能[3]を獲得し(貪食性アストロサイト)、死細胞断片などの不要物質を貪食する(食べる)ことにより脳内から除去すること、およびその分子メカニズムの一端を明らかにしました。これらの働きは主に、神経機能の回復に重要と考えられている時期および場所 (梗塞辺縁部 (ペナンブラ)[4]) で観察されたことから、脳梗塞後の組織の修復及び再構築と大きく関与し、脳梗塞の予後に影響している可能性が示唆されました。
本研究成果は、Nature Communications誌に掲載されます(日本時間平成29年6月22日午後6時 オンライン版掲載予定)。
脳卒中は脳梗塞、脳出血及びくも膜下出血等からなる脳血管障害で、国内の患者数、約120万人の重篤な疾患です。我が国死亡原因の第4位を占め、また一命をとりとめたのちも、重篤な後遺症(片麻痺、運動・意識障害、失語、疼痛)に悩まされる患者さんは多く、その予防、治療、さらにより良好な予後を確保する戦略が医学的にも社会的にも重要な課題になっています。脳血管障害で、最も割合の多い疾患が脳梗塞です。脳梗塞は、脳血管が詰まって脳血流が滞ることで(虚血) 、酸素・栄養が神経細胞に届かなくなるために、脳が傷害され、やがて死に至る疾患です。素早く血流を確保することが最も重要ですが、血流を再開させた後に脳機能がうまく回復しなかったり、脳の機能障害が徐々に進行する等、未解決の問題が多く、またこれらに対する有効な治療法は非常に乏しいのが現状です。脳梗塞により引き起こされる脳内の分子病態を正確に理解し、新たな治療戦略・治療法の開発を確立することが急務であると言えます。
脳梗塞による傷害を免れた脳部位を、上手に保護し回復させるためには、血流の確保に加えて、脳梗塞により惹起された種々のダメージを取り除き、脳内環境を整える必要があります。これまで、このような役割を担う細胞は、ミクログリア[5]と呼ばれる脳内免疫担当細胞であると考えられていました。ミクログリアは、非常に応答性が早い細胞で、様々な脳の疾患、外傷、さらに感染により異物が脳内に侵入した場合は、素早く当該部位へ集まり、死細胞及び死細胞から流出する有害物質、異物などを食べて除去します。ミクログリアは、完全に死んでしまった神経細胞等を取り除くためには重要な細胞ですが、脳梗塞後のペナンブラ領域(梗塞の辺縁部)等、今後の回復が期待される脳部位での、細胞修復や環境整備に関係しているかどうかはよく分かっていませんでした。今回、アストロサイトと呼ばれる別のグリア細胞が、このペナンブラ領域で、貪食性を獲得し、「貪食性アストロサイト」に変化することが明らかになりました。アストロサイトは、神経細胞や血管周囲に豊富に存在し、神経細胞を物理的に支持したり、血管からの栄養を神経細胞に伝える重要な役割を担っている細胞です。今回このアストロサイトが、脳梗塞後に貪食能を獲得することで、第2の貪食細胞として、ペナンブラ領域の環境整備、脳の修復に関与している可能性が明らかになりました。
今回、研究チームは、マウスの脳卒中モデルである、一過性脳梗塞モデル[6]を用いて、これまでおとなしい神経組織の支持細胞と考えられてきたアストロサイトが、脳梗塞後に「貪食性アストロサイト」に変身し、傷害された神経細胞やその突起、さらにシナプス[7]等を貪食により除去していることを発見しました。これまで、死細胞を貪食により除去すると考えられていたのはミクログリアですが、ミクログリアは、脳梗塞後直ぐに梗塞巣の中心部位 (コア) [4] へと集積して多数の死細胞を貪食により取り込みます。一方、貪食性アストロサイトは傷害から1週頃をピークにゆっくりと主に梗塞巣周辺部位に集積し、脳梗塞により傷ついた神経細胞、シナプスを貪食することがわかりました。アストロサイトとミクログリアは、脳梗塞後に、異なる時期、傷害程度が異なる部位で、それぞれ貪食作用を示していること、また3次元電子顕微鏡[8]による詳細な観察から、貪食により取り込む細胞断片の量は、両細胞で同程度であることが明らかになりました。つまり、アストロサイトも十分な量の貪食を行う貪食細胞に変身することができ、ミクログリアとは異なる時期・空間で、その貪食作用を発揮していることが明らかになりました。
また、アストロサイトが貪食能を獲得する分子メカニズムとして、ABCA1[9]という分子の発現が亢進することを見出しました。脳梗塞後にアストロサイトはABCA1を強く発現し、ABCA1依存的に貪食します。アストロサイト特異的にABCA1を欠損させたマウスでは、脳梗塞後の貪食が著しく低下し、梗塞巣の周辺部位により多くの死細胞の断片が蓄積する傾向があることも明らかになりました。脳梗塞後の細胞断片の残存は、組織・神経回路の再構築・修復の障害になることから、アストロサイトが貪食性を獲得し、脳内微小環境を整備している可能性が予想されます。
本研究は、日本学術振興会 新学術領域研究「グリアアセンブリの動作原理の解明」(研究代表者:小泉修一教授)、挑戦的萌芽研究、基盤研究(B)、若手研究(B)、 特別研究奨励費、及び
及び日本医療研究開発機構(AMED)の革新的先端研究開発支援事業(AMED-CREST)「脳神経回路の形成・動作原理の解明と制御技術の創出」(研究代表者:鍋倉淳一教授、研究分担者:小泉修一教授)、山梨大学最先端脳科学研究による支援を受けて行われました。なお、AMED-CRESTにおける本研究開発領域は、平成27年4月の日本医療研究開発機構の発足に伴い、国立研究開発法人科学技術振興機構(JST)より移管されたものです。
本研究によって、脳梗塞後に、アストロサイトが貪食性を獲得すること、及びその分子メカニズムが明らかになりました。また、貪食性アストロサイトの活動が、脳梗塞の予後に大きく影響する可能性が示唆されました。今後は、アストロサイトの貪食が、梗塞辺縁領域の修復・再構築に与える影響を精査し、そのコントロールを可能とする薬物等を見出すことにより、アストロサイトの視点から脳卒中の予後及びリハビリ等に役立つ戦略開発に結びつけたいと考えています。
[1] グリア細胞
脳を構成する神経細胞以外の細胞群。グリア細胞は、神経細胞のように電気的な興奮性を示さない一方で、カルシウムイオン等の細胞内イオン濃度変化を利用して情報を授受していると考えられている。グリア細胞にはアストロサイト、ミクログリア、オリゴデンドロサイトなどが含まれる。
[2] アストロサイト
グリア細胞の一種で、神経細胞の周囲に豊富に存在し、神経細胞の物理的支持、栄養供給などを行う。近年、アストロサイトも伝達物質を放出し、神経伝達、ひいては脳機能に影響を及ぼすことが明らかになり、注目を集めている。一方、脳外傷、脳梗塞などの急性傷害だけでなく、慢性神経変性疾患など、ほぼ全ての脳病態時に活性化型と呼ばれる状態へと遷移し、その形態・性質を激変させることも知られる。
[3] 貪食
死細胞やその断片などの不要異物を細胞内へと取り込み、除去する作用。
[4] 梗塞巣 (コア) と傷害辺縁部 (ペナンブラ)
脳梗塞によって生じる傷害は、修復不可能なダメージを受けた不可逆的な梗塞部位 (梗塞巣) と血流の低下は伴うが細胞死を免れ、血管の再開通などによって救出可能な梗塞巣周囲の傷害辺縁部 (ペナンブラ) に分けられる。
[5] ミクログリア
グリア細胞の1種で、脳内における免疫担当細胞。正常時には、細かな突起を周囲に伸ばして周辺環境を監視し、病態時には、環境の変化を察知し、その性質を変化させる。炎症応答や脳内不要物質の除去だけでなく、神経細胞の保護などその機能は多岐に渡る。
[6] 一過性脳梗塞モデル
本研究では中大脳動脈閉塞モデルを用いた。塞栓糸を頚動脈から中大脳動脈まで挿入、留置することで脳虚血を誘導した。一定時間後、塞栓糸を引き抜き、閉塞を解除(再灌流)し、一過性の脳梗塞を起こした。
[7] シナプス
神経細胞同士の接続部分で、神経細胞間の信号伝達部位。神経回路網の最小ユニット。シナプスが新たに形成・消去することで神経回路が再構築され、学習や記憶といった脳機能が実現されると考えられる。シナプスの再構築は病態時にもよく観察され、脳梗塞後は特にペナンブラ領域で頻繁に起こるとされる。
[8] 3次元電子顕微鏡
電子顕微鏡では光の代わりに電子線を利用し、光学顕微鏡では検出限界以下の超微細構造を可視化することができる。ミクロトーム組み込み式走査型電子顕微鏡 (SBF-SEM) を用いて、連続断面画像を取得し、得られたデータをコンピュータ上で3次元再構築することで、超微細構造を3次元立体的に観察した。
[9] ABCA1
ABCトランスポーターの一種で、線虫で発見された貪食必須遺伝子ced−7の哺乳類相同遺伝子。マウスにおいても発達期のマクロファージによる貪食に重要であることが報告されている。MEGF10、GULP1といった分子と共役して貪食に重要な役割を果たすことが知られる。

A. 細胞内に細胞断片(デブリ)を取り込んだアストロサイト (電子顕微鏡観察像)。
ピンク: アストロサイト; 赤、矢印: デブリ (貪食小胞)、黄、矢尻: 肥大化した中間径フィラメント、アスタリスク: グリコーゲン顆粒
B. 梗塞傷害側では頻繁にアストロサイト内で貪食されたデブリが観察されたが、非梗塞側のアストロサイト内では観察されなかった。
C. アストロサイト特異的ABCA1欠損マウス内のアストロサイトでは、貪食したデブリが少なく、この結果からABCA1がアストロサイトの貪食に重要であることが示唆される。
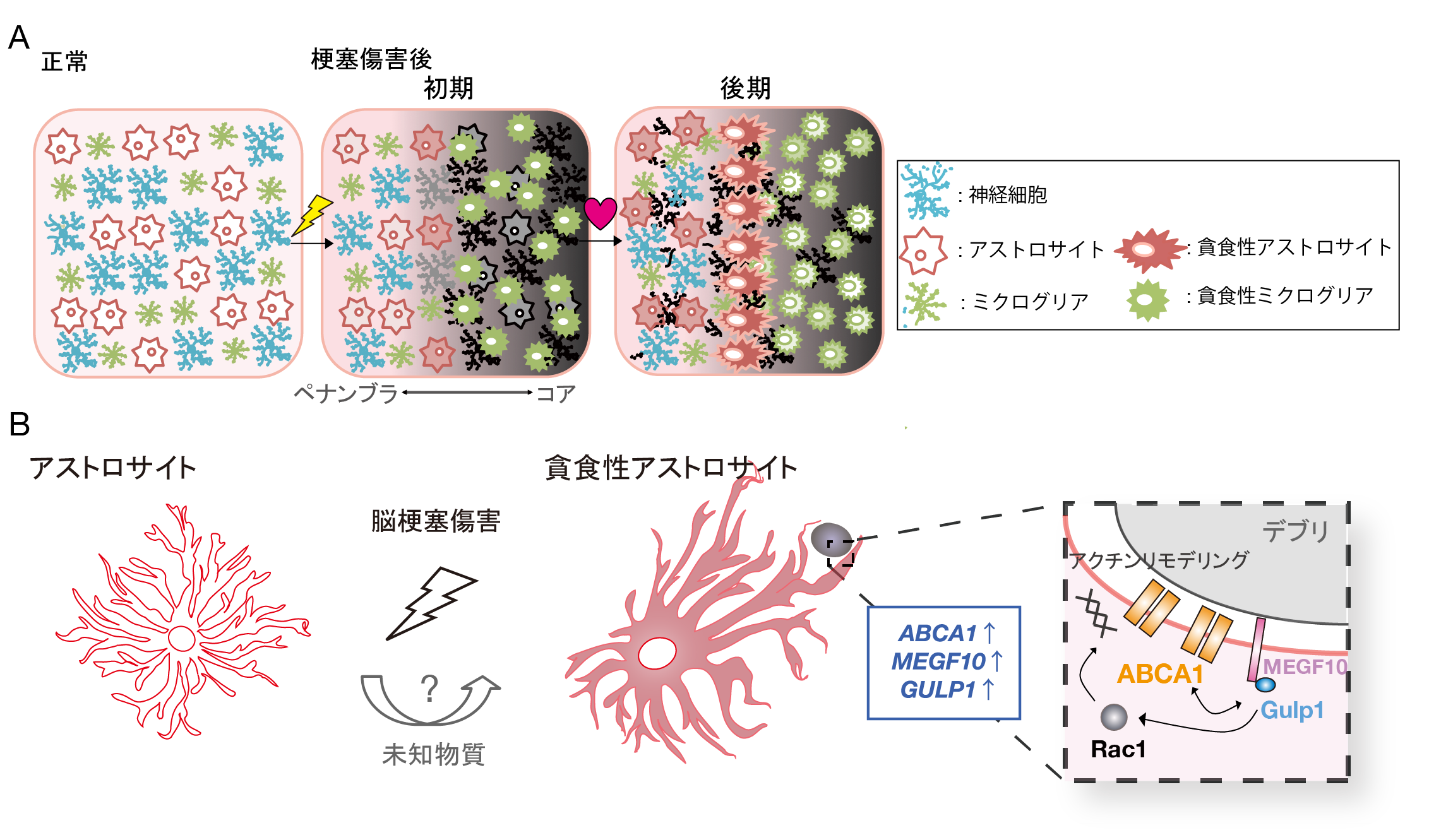
A. 脳梗塞傷害によりコアで多数の細胞死が生じると、まずミクログリアが検知して、集積し、死細胞などを多数貪食する。ミクログリアに遅れてアストロサイトも活性化状態へと変化し、貪食性を亢進させる。ミクログリアは傷害の初期にコアで、アストロサイトは傷害の後期にペナンブラで貪食性を亢進させていた。
B. 脳梗塞傷害後、未知の物質によって、アストロサイトでABCA1の発現亢進が誘導され、貪食性を獲得する。ABCA1はMEGF10、GULP1と共役してデブリを細胞内へと取り込む。
Reactive astrocytes function as phagocytes after brain ischemia via ABCA1-mediated pathway
Yosuke M Morizawa, Yuri Hirayama, Noubuhiko Ohno, Shinsuke Shibata, Eiji Shigetomi, Yang Sui, Junichi Nabekura, Koichi Sato, Fumikazu Okajima, Hirohide Takebayashi, Hideyuki Okano, and *Schuichi Koizumi *責任著者
Nature Communications 2017年6月22日(木)付け: 日本時間6月22日(木)午後6時オンライン掲載
掲載URL: http://www.nature.com/ncomms
<研究に関する問合せ>
国立大学法人 山梨大学 医学部
薬理学講座 教授 小泉 修一(コイズミ シュウイチ)
大学共同利用機関法人 自然科学研究機構 生理学研究所 教授 鍋倉 淳一(ナベクラ ジュンイチ)
慶應義塾大学医学部 生理学教室 教授 岡野 栄之(オカノ ヒデユキ)
国立大学法人 新潟大学 大学院医歯学総合研究科 神経生物・解剖学分野
教授 竹林 浩秀(タケバヤシ ヒロヒデ)
国立大学法人 群馬大学 生体調節研究所 准教授 佐藤 幸市(サトウ コウイチ)
<報道に関する問合せ>
国立大学法人 山梨大学 総務部総務課広報企画室
大学共同利用機関法人 自然科学研究機構 生理学研究所 研究力強化戦略室
慶應義塾大学信濃町キャンパス総務課 広報担当
国立大学法人 新潟大学 広報室
国立大学法人 群馬大学 総務部総務課広報係.
<AMEDの事業に関する問合せ>
国立研究開発法人 日本医療研究開発機構(AMED)
基盤研究事業部 研究企画課






国立大学法人 山梨大学
大学共同利用機関法人 自然科学研究機構 生理学研究所
慶應義塾大学医学部
国立大学法人 新潟大学
国立大学法人 群馬大学
国立研究開発法人 日本医療研究開発機構