|
●細菌の膜電位感受性カルシウムチャネルを世界で初めて発見した。
●ヒトのカルシウムチャネルにも共通する選択的なイオン透過機構について、新たな知見が得られた。
●このカルシウムチャネルは先祖型の特徴を保持していると考えられ、イオンチャネルの進化についての知見が得られた。
●効果的なカルシウム拮抗剤の開発などに貢献することが期待される。
我々の思考や記憶および身体を動かすことは脳や筋肉における神経活動のたまものです(図1A)。これらの神経活動は神経細胞の細胞膜上に存在する特定のイオンのみを選択的に透過する孔であるイオンチャネルの働きによるものです(図1B)。例えば、ナトリウムイオン(Na+)の細胞内への流入が神経細胞内の電気信号の伝達を行い、カリウムイオン(K+)の細胞外への流出が速やかなに信号を消失することで電気信号の逆流や過剰な伝達を防ぎます。これらと同様に、カルシウムは人体に必須のミネラルであり、脳や筋肉など身体のほぼ全ての臓器・細胞で重要かつ多様な生理機能に関わっています。
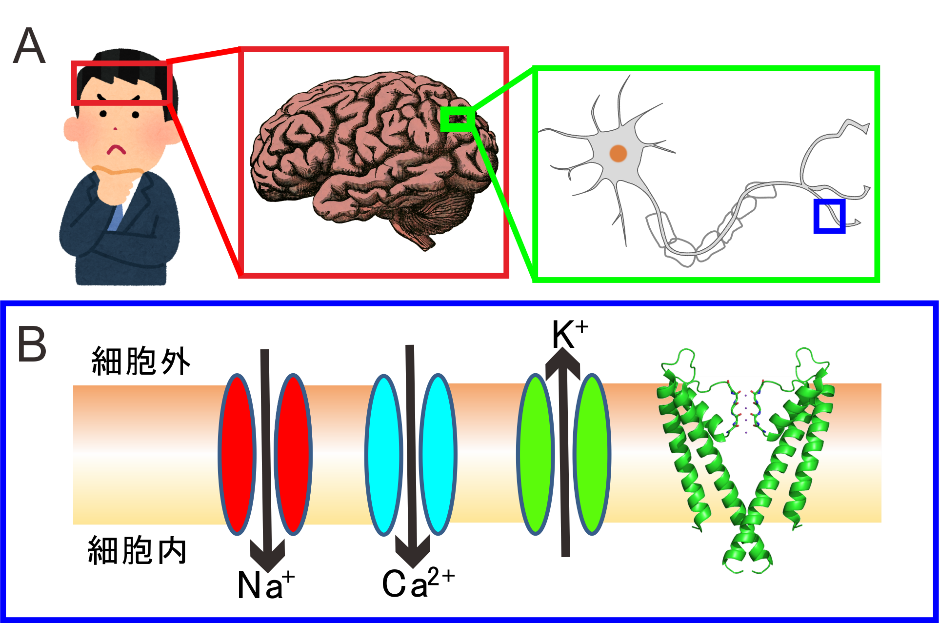 図1. A:我々は脳で物事を考え(赤枠)、脳は神経細胞の集合体であり(緑枠)、神経細胞はイオンチャネルの働きにより発生する電気信号を用いて情報の伝達を行う(青枠)。 B: 選択的なイオン透過を行うチャネル。上図は世界で初めて決定されたカリウムチャネルの立体構造。この構造をもとにしたカリウムイオンの選択的なイオン透過機構の解明に対して2003年度ノーベル化学賞が授与された。 図1. A:我々は脳で物事を考え(赤枠)、脳は神経細胞の集合体であり(緑枠)、神経細胞はイオンチャネルの働きにより発生する電気信号を用いて情報の伝達を行う(青枠)。 B: 選択的なイオン透過を行うチャネル。上図は世界で初めて決定されたカリウムチャネルの立体構造。この構造をもとにしたカリウムイオンの選択的なイオン透過機構の解明に対して2003年度ノーベル化学賞が授与された。 |
例えば、脳や末梢の神経細胞の連結部(シナプス)では、神経細胞での電気信号が細胞内へのカルシウムイオン(Ca2+)の流入を引き起こし、これを引き金として神経伝達物質がシナプス間隙に放出され、次の神経細胞における電気信号の発生を促します。この電気信号は細胞内外の電位差(膜電位)の変化として伝達されますが、膜電位変化とCa2+流入を結びつけるタンパク質が膜電位感受性カルシウムチャネルです(図1B)。こうした重要性からカルシウムチャネルの阻害剤は臨床的に有用であり、血管平滑筋の機能を調整する高血圧や狭心症に対する薬剤などとして利用されています。
私たちヒトを含む多細胞生物のカルシウムチャネルの分子構造は、よく似たアミノ酸配列1からなる基本単位が4つ連結した特徴的なものです(図2A)。この特徴は、Ca2+ではなくNa+を流入させるナトリウムチャネルでも共通であり、これらのチャネルは進化的に同一の起源を持つとされます。一方、細菌などの単細胞生物ではカルシウムチャネル、ナトリウムチャネルとよく似た分子構造を持つものが見つかっていますが、それは同一の基本単位が四つ集まってできた単純なものです(図2B)。この1つの基本単位が進化の過程で2倍、4倍と2回コピーされ連結したのちに各基本単位がそれぞれ進化した結果、私たちが持つような4リピート型の分子構造になったと考えられています(図2A)。進化的にはナトリウムチャネルよりも先にカルシウムチャネルが出現したと考えられていますが、これまでは細菌からはカルシウムチャネルは見つかっていませんでした(図2C)。細菌のカルシウムチャネルはどのような特徴を持ち、私たちのカルシウムチャネルとどのような相違点があるのか、また、そもそも存在するのか?という問題は、イオンチャネルの進化と起源を考えるうえで重要であり、我々の思考などをつかさどる基本素子が如何にして生まれたかを知る鍵となります。
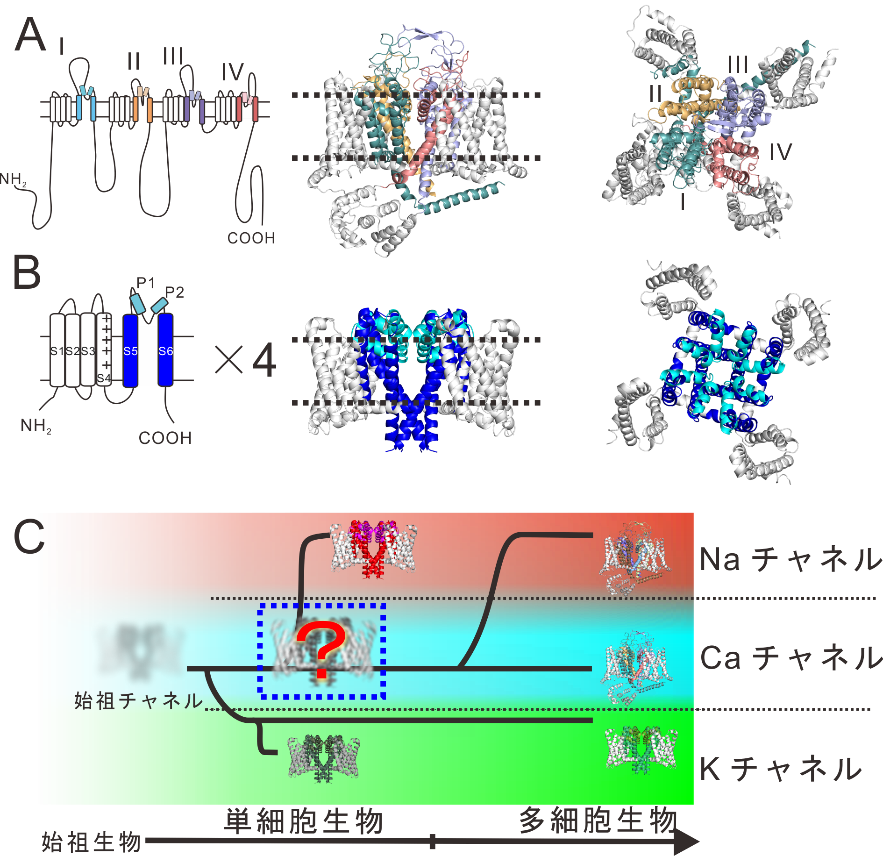 図2. A: 高等生物のNa及びカルシウムチャネルの基本構造。B: 細菌のナトリウムチャネル(BacNav)の基本構造。C:イオンチャネルの進化の過程の模式図。細菌のカルシウムチャネル(青枠)はチャネルの進化の鍵を握る位置にあり、存在が予測されていたがこれまで同定されていなかった。 図2. A: 高等生物のNa及びカルシウムチャネルの基本構造。B: 細菌のナトリウムチャネル(BacNav)の基本構造。C:イオンチャネルの進化の過程の模式図。細菌のカルシウムチャネル(青枠)はチャネルの進化の鍵を握る位置にあり、存在が予測されていたがこれまで同定されていなかった。 |
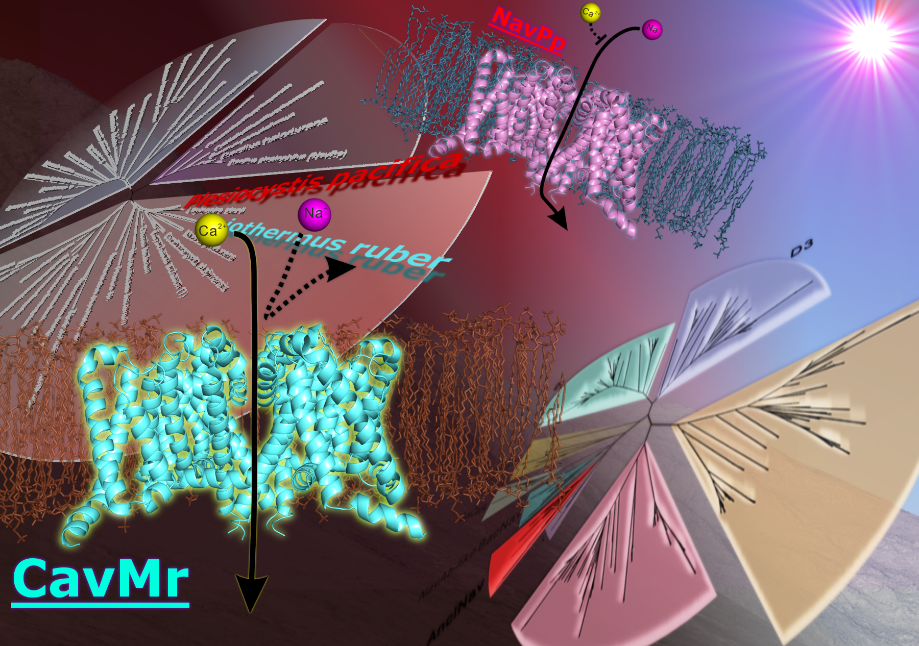
今回私たちの研究グループは、まず、細菌のカルシウムチャネルの発見を目的とし遺伝子データベースから様々な細菌のナトリウムチャネル(BacNav)に似ている遺伝子の探索と分子系統学的解析2を行いました。その結果、既知のBacNavとは異なるアミノ酸配列の特徴を持つ新たなグループを発見しました。このグループには生命の共通先祖に比較的近い細菌から見つかった遺伝子も含まれていたことから、このグループをAnclNav(Ancestor-like BacNav)と名付けました(図3A)。AnclNavの一群から、いくつかの遺伝子を単離し、培養細胞を用いたパッチクランプ法3によりチャネル活性を測定したところ、Meiothermus ruberおよびPlesiocystis pacificaの2種の細菌から単離した遺伝子を導入した細胞でイオンチャネル電流が確認できました。特に、好熱菌4であるM. ruber由来のものはCa2+をよく通しました。すなわち、これは世界で初めて発見された細菌のカルシウムチャネルになります(図3B左)。
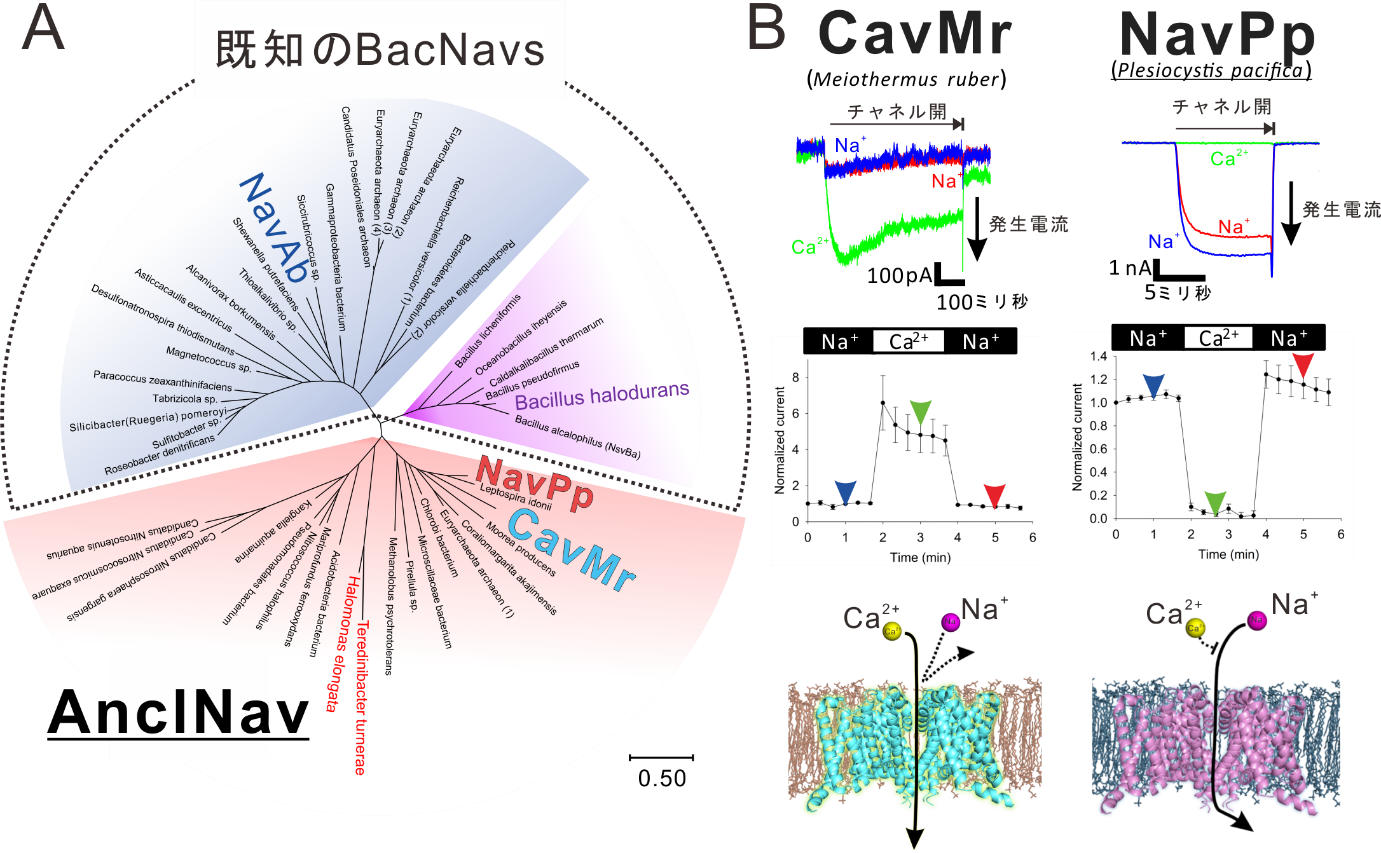 図3. A:分子系統学的解析によって作製した系統樹。B:二つのAnclNavであるCavMrとNavPpによるチャネル電流。緑の線がカルシウムイオンによる電流を示す。赤と青はナトリウムイオンによる電流。下図は選択的なイオンの透過を示した模式図 図3. A:分子系統学的解析によって作製した系統樹。B:二つのAnclNavであるCavMrとNavPpによるチャネル電流。緑の線がカルシウムイオンによる電流を示す。赤と青はナトリウムイオンによる電流。下図は選択的なイオンの透過を示した模式図 |
さらに、もう一方のAnclNavであるP. pacifica由来のチャネル(NavPp)はNa+をよく通すもののCa2+によって透過が阻害されるという、これもまた、これまでにない特徴を持つチャネルでした(図3右)。
イオンチャネルの通すイオンを決める重要な部分としてチャネル中央部にあるイオンの透過経路に面している領域があり、この領域は物質をこしたりふるい分けたりする装置であるフィルターに見立ててイオン選択性フィルターと呼ばれます(図4A)。CavMrの選択性フィルター配列をアミノ酸の一文字略号5で示すとTLEGWVDとなります。BacNav の一種であるNavAbはナトリウムチャネルでありフィルター配列はTLESWSMですが、選択性フィルターのアミノ酸配列にグルタミン酸(E)やアスパラギン酸(D)などの酸性アミノ酸を人為的に導入してTLDDWSDとするとカルシウム選択性を示すことが知られており、これは人工カルシウムチャネルとしてCavAbと呼ばれています。そこで、Ca選択性を示す3つのチャネル、すなわちCavMrとCavAbそしてヒトのカルシウムチャネルの脳や心臓で機能する一種であるCav3.1の選択性フィルターのアミノ酸配列を比較したところ、CavMrの配列はCav3.1に近いことがわかりました(図4A)。Cav3.1は四つの繰り返しリピートからなるチャネルのため、フィルター配列もそれぞれ異なりますが、1番目のリピートと3番目のリピートの配列がCavMrに似ていました(図4C)。一方で、CavAbの配列は全体的に酸性アミノ酸が多くCav3.1やCavMrの配列とは大きく異なっていました(図4C)。カルシウム選択性の分子機構について、これまでは人工カルシウムチャネルのCavAbの立体構造に基づいて議論されてきましたが、この結果は天然のカルシウムチャネルであるCavMrやCav3.1などのヒトCavのカルシウム選択性の分子機構はCavAbの構造から議論されたものと異なることを示唆しています。
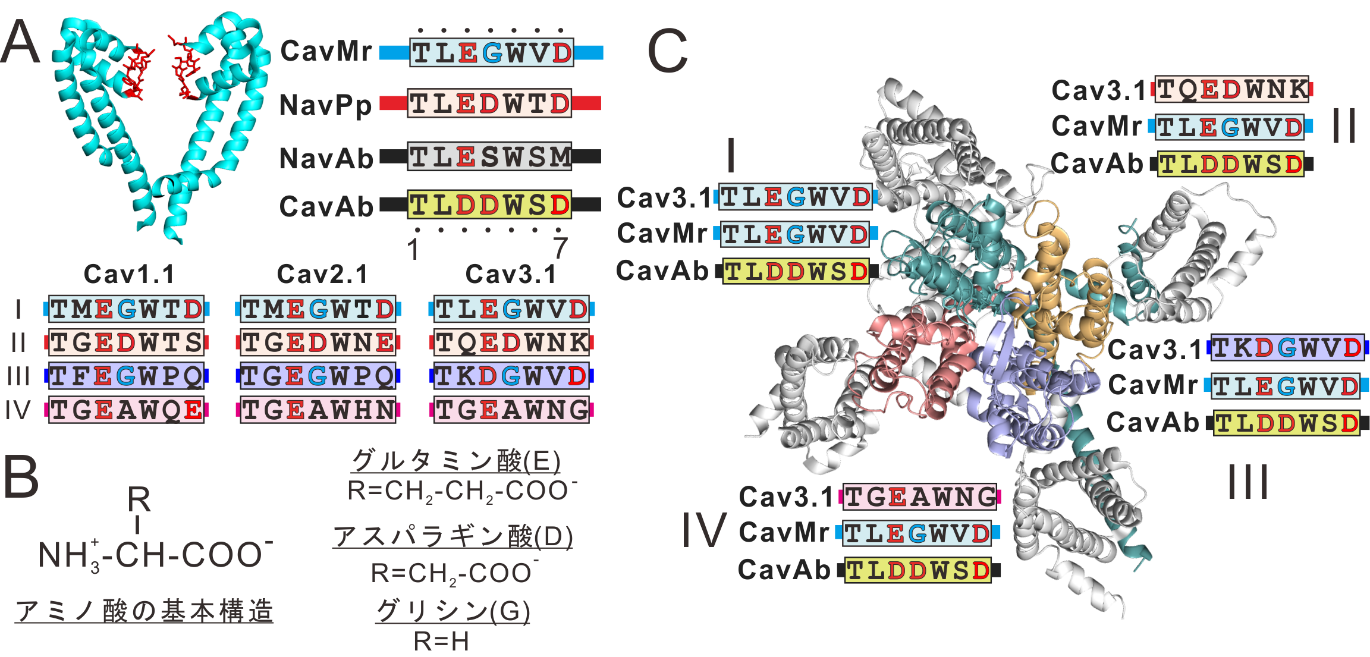 図4. A:イオンチャネルにおける選択性フィルター領域とそのアミノ酸配列の一文字略号表記5。B:アミノ酸の基本構造。Rは側鎖を示す。C:CavMr, CavAb,ヒトCav3.1の三種類のカルシウムチャネルのフィルター配列の比較。酸性アミノ酸であるグルタミン酸(E)とアスパラギン酸(D)を赤文字で示した。CavMrとCav3.1で保存されているグリシン(G)を青文字で示した。 図4. A:イオンチャネルにおける選択性フィルター領域とそのアミノ酸配列の一文字略号表記5。B:アミノ酸の基本構造。Rは側鎖を示す。C:CavMr, CavAb,ヒトCav3.1の三種類のカルシウムチャネルのフィルター配列の比較。酸性アミノ酸であるグルタミン酸(E)とアスパラギン酸(D)を赤文字で示した。CavMrとCav3.1で保存されているグリシン(G)を青文字で示した。 |
CavMrのフィルター配列は、CavAbよりも酸性アミノ酸(EやD)の数が少なく、ヒトのCavのリピート1とリピート3に見られるグリシン(G)が保存されていることが特徴です。そこで最後に、CavMrの選択性フィルターにおける酸性アミノ酸とグリシンの重要性を調べるべくCavMrとNavPpの注目するグリシンの位置にあるアミノ酸を他のアミノ酸に変換した変異体を作製しその機能を調べました。
まず、CavMrの選択性フィルターの酸性アミノ酸を増減させてみたところ、減らした変異体である選択性フィルターの7番目のアスパラギン酸(D)をメチオニン(M)に変異した変異体であるCavMr-D7Mでは高いカルシウム選択性が保持された一方、増やした変異体であるCavMr-G4Dではカルシウム選択性が著しく減少しました(図5A)。この結果は、選択性フィルターに多くの酸性アミノ酸を持つNavPpが予想に反してNa+をよく透過することにも合致します。さらに、NavPpの選択性フィルターの配列をCavMrのものに置換した変異体(NavPp-Mr)は酸性アミノ酸の数は減少するにもかかわらず高いカルシウム選択性を獲得しました(図5B)。これらの結果は、酸性アミノ酸の数がカルシウム選択性の高さと相関するという人工チャネルを基にした従来のモデルとは明らかに合致しません。
加えて、CavMrのグリシン残基をNavAbで見られるセリンに置換したCavMr-G4S変異体はカルシウム選択性を消失し(図5A)、NavPpにCavMrに見られるグリシンのみを導入したNavPp-D4Gは比較的カルシウム選択的なイオン透過が可能になりました(図5B)。この結果は、酸性アミノ酸ではなく最も単純で小さいアミノ酸であるグリシンがカルシウム選択性に重要であることを示しています。このグリシンは、ヒトの膜電位感受性カルシウムチャネルだけでなく類似した他の多細胞生物のカルシウムチャネルなどにおいてもよく保存されているものの、カルシウム選択性への寄与はあまり注目されていませんでした。以上の結果は、これまで見落とされてきた選択性フィルター内のグリシンによる、細菌からヒトにまでおよぶ高度に保存されたカルシウム選択性機構の存在を想起させるものです。
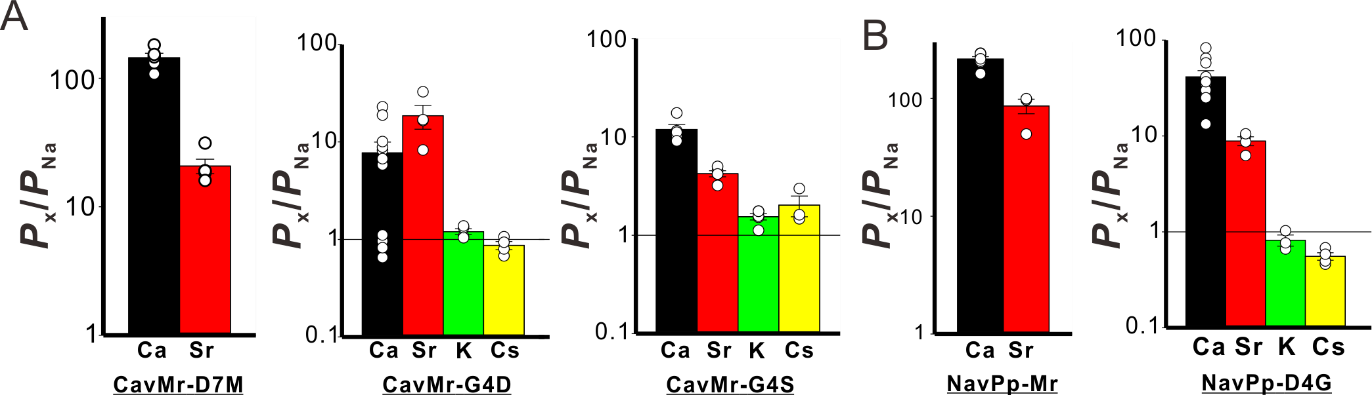 図5. A、B:CavMrとNavPpの各変異体における各イオンのナトリウムイオンと比較した透過効率。縦軸はナトリウムイオンの何倍通りやすいかを示す。 |
今回の結果は、古くからその存在が予想されながらも長く未発見であった細菌の膜電位感受性カルシウムチャネルの存在を実証したものであり、幅広い研究分野に影響を与えると期待されます。CavMrの属するAnclNavグループは、我々ヒトも含めた多細胞生物ナトリウムチャネルやカルシウムチャネルの祖先型の特徴を保持したチャネルである可能性が高く、イオンチャネルの進化についての理解を大きく進展させ、今後新たな研究を促すことが期待されます。また、細菌がカルシウムチャネルを保持しているという事実からは、進化の初期段階においても生物が膜電位変化を細胞内での様々な役割を持つカルシウムシグナリングと結びつけていたことが想定され、我々高等動物の筋収縮や神経伝達をつかさどるシステムの原型が進化的にかなり初期の段階から存在していたことを示唆する興味深い知見です。
また、CavMrのイオン選択性についての変異体の解析結果はカルシウムチャネルの本質的な機能であるカルシウム選択性について、重要な知見を与えるものでした。これらの結果は、自然が採用したカルシウム選択性の分子基盤は人為的に作製したカルシウムチャネルのものとは異なるものであることを強く示唆します。CavMrのさらなる研究からカルシウム選択性の詳細な分子機構の理解が進み、より有効性の高いカルシウム拮抗剤などの新薬の開発に繋がると期待されます。
基礎生物研究や臨床研究に対しても、ナトリウムチャネルであるBacNavが神経活動を恒常的に増進させる遺伝学的道具として使用されてきた実績があり、CavMrも同様にカルシウムシグナリングを亢進させるツールとしての応用も期待できます。カルシウムシグナリングは細胞増殖などにも関わっており、特定の神経細胞にCavMrを発現させることで損なわれたカルシウムシグナルを回復させたり、過剰に発現させることで特定の癌細胞を死滅させたりするなどの幅広い利用方法が考えられます。
1)アミノ酸配列:タンパク質は側鎖(図4B)が異なる約20種類のアミノ酸が脱水縮合しペプチド結合により重合してできている。この繋がりをアミド基(図4B:NH2+-)側から順に並べたものがアミノ酸配列となり、アミノ酸配列の違いによりたんぱく質が様々な機能を示すことができる。
2)分子系統解析: 遺伝子DNAの塩基配列やタンパク質のアミノ酸配列の類似性をもとにして、生物種やタンパク質の近縁性および進化を解析する手法。
3)パッチクランプ法: 極めて小さな先端径を持つガラス電極を細胞膜に密着させることで、細胞内外の電流の漏れを最小限に抑えながら細胞に発現するチャネル電流を測定する手法。
4)好熱菌: 温泉や熱水噴出孔などの高温環境に生育する原核生物。進化的に古い起源を持つ生物であることが多い。
5)アミノ酸の一文字略号:タンパク質を構成する20種類のアミノ酸をそれぞれアルファベット一文字で表記する方法。グリシンはG、グルタミン酸はE、アスパラギン酸をDでそれぞれ表す。
本研究は、日本学術振興会(JSPS)科学研究費助成事業・基盤研究(S)(課題番号15H05775)、若手研究(B)(課題番号17K17795)日本医療研究開発機構(AMED)創薬等先端技術支援基盤プラットフォームならびに次世代治療・診断実現のための創薬基盤技術開発事業「革新的中分子創薬基盤技術の開発」の支援のもとで行われました。
また、本研究は東京医科歯科大学と生理学研究所との共同研究として行われました。
掲載誌: eLife
論文タイトル: “A native prokaryotic voltage-dependent calcium channel with a novel selectivity filter sequence”
著者: Takushi Shimomura, Yoshiki Yonekawa, Hitoshi Nagura, Michihiro Tateyama, Yoshinori Fujiyoshi and Katsumasa Irie
DOI: https://doi.org/10.7554/eLife.52828
【研究者連絡先】
名古屋大学細胞生理学研究センター
助教 入江 克雅
自然科学研究機構 生理学研究所 神経機能素子研究部門
助教 下村 拓史
【報道連絡先】
名古屋大学総務部総務課広報室
自然科学研究機構 生理学研究所 研究力強化戦略室


名古屋大学細胞生理学研究センター(CeSPI)
名古屋大学大学院創薬科学研究科
自然科学研究機構 生理学研究所