| 人や動物において、記憶や学習能力は脳内の神経細胞が担っています。特に、神経細胞同士を繋ぐシナプスの大きさなどの状態が変化することが記憶・学習にとって重要であることが分かってきています。また、認知症等の多くの神経疾患ではシナプスの消失や退縮が見られることが分かってきています。今回、自然科学研究機構 生理学研究所の村越秀治准教授らのグループは、生きた動物内で脳神経細胞のシナプスの大きさや機能を1つずつ光で強化することが可能な光応答性酵素の開発に成功しました。今後、この光応答性酵素を用いて記憶の仕組みを調べることができるだけでなく、弱ったシナプスを回復させるなど、記憶障害の治療法の開発が進むと考えられます。本研究結果は米国科学雑誌Nature Communications誌(日本時間2021年2月2日19時解禁)に掲載されました。 |
神経細胞から次の神経細胞へ情報を伝える部位をシナプスと呼びます。近年、シナプスの変化が、記憶や学習、またこれらに関係した神経疾患と深い関係があることが明らかになってきました。シナプスの大きさや構成分子が変化すると、神経細胞同士の電気信号の伝達効率が変化します。たとえばシナプスの体積やシナプス内のグルタミン酸受容体が増えることで、情報伝達効率が向上することが分かっています。このような伝達効率の変化は「シナプス長期増強」と呼ばれ、記憶や学習の分子基盤となっていると考えられています。もし、個々のシナプスの状態を非侵襲的に操作することができれば、神経疾患の治療法の開発や記憶・学習メカニズムの解明が進むと考えられますが、現在までにそのようなツールはありませんでした。
本研究では、非侵襲的にシナプスの状態を操作することを可能にするため、まず、シナプス可塑性に重要であると考えられる「CaMKII」(注1)と呼ばれるタンパク質に着目しました。CaMKIIとは神経細胞の中に豊富に存在し(全てのタンパク量の内、数パーセントを占める)、記憶や学習の基盤となるたんぱく質です。光照射の有無によってCaMKIIの活性化を操作可能にするため、CaMKIIに植物のタンパク質(Phototropin1)の光感受性部位(LOV2ドメイン、注2)を遺伝子工学的に融合しました。数百種類のDNAを作製・テストした結果、青色光や集光した近赤外光の照射によって活性化する遺伝子コード型の光応答性CaMKIIの開発に成功しました(図1)。光応答性CaMKIIはDNAでコードされているため、DNAを細胞に導入すると、細胞内でそのDNAを使って光応答性CaMKIIのタンパク質が作られます。細胞内で作られた光応答性CaMKIIは光を照射することによって活性化しますが、光照射されていない状態では活性化は起こりません(図1)。
今回開発した光応答性CaMKIIが実際に光照射に対してどのように反応しているかを確かめるため、海馬スライスの神経細胞に光応答性CaMKIIを導入し光刺激を行いました(図2a)。具体的には、2光子顕微鏡を用いて細胞を観察し、同時に光刺激を個々のシナプスのスパインと呼ばれる部位に与えました。2光子励起(注3)を用いると組織深部で1マイクロメートル(1000分の1ミリメートル)という非常に狭い範囲で光刺激を行うことができます。2光子励起の刺激範囲とスパインの大きさはほぼ同じなので、スパインに光刺激をすることによって、スパイン内の光応答性CaMKIIだけを活性化することができます。
実験の結果、光応答性CaMKIIを活性化させるとスパイン体積が数倍大きくなり、変化は4時間以上持続することが分かりました(図2b,c)。また。グルタミン酸受容体のスパインへの集積も同時に観察されました(図2d,e)。これらの結果は、光刺激によって神経細胞同士の情報伝達効率が向上していることを示しています。
さらに、本研究では生きた個体動物脳内でもシナプスの強化ができるかどうかを調べました。マウスにアデノ随伴ウイルスを用いて光応答性CaMKIIを導入し(図3a)、覚醒状態で光刺激を与えました。この結果、生きた個体動物内においてもシナプス内で光応答性CaMKIIを活性化させることでシナプスの強化が行えることを明らかにしました(図3b)。
村越准教授は「今回の研究では、光応答性に改変したCaMKII酵素を用いることで、生きた動物内で個々のシナプスの機能を強化することに成功しました。また、本研究で開発した分子デザインは細胞内に存在する様々なタンパク質に応用が可能であるため、将来の光医療開発に繋がる画期的な成果であると考えられます」と話しています。
本研究は文部科学省科学研究費補助金、およびJST戦略的創造研究推進事業 個人型研究(さきがけ)、CREST「次世代フォトニクス」研究領域における研究課題「超短赤外パルス光源を用いた顕微イメージング装置の開発と生命科学への応用」(研究代表者:藤 貴夫)の補助を受けて行われました。
注1:CaMKII
CaMKIIは記憶や学習に関与する神経細胞内の主要な酵素で12量体を形成しておりシナプスに存在している。CaMKIIはシナプスへのカルシウムイオン流入によって活性化し、他の様々なタンパク質を活性化(リン酸化)することによって、シナプス内の分子状態や構成分子を大きく変化させると考えられている。
注2:LOV2ドメイン
LOV2ドメインは植物のタンパク質であるPhototropin1にある青色光受容領域。青色光を吸収することで分子構造が変化する。
注3:2光子励起
組織内での散乱が少ない長波長のレーザーを用いて、2つの光子をほぼ同時に細胞内の蛍光分子に当てると、蛍光を放出させることができる(2光子励起現象)。2光子励起は非常に狭い領域(1 マイクロメートル程度)でしか起こらないため、微小領域で光応答性分子を活性化させることができる。
1.遺伝子コードされた光応答性CaMKIIの開発に成功。
2.光応答性CaMKIIを海馬神経細胞のシナプス内で活性化させることでシナプスの強化に成功。
3.生きた個体動物(マウス)においてもシナプス機能の強化に成功。
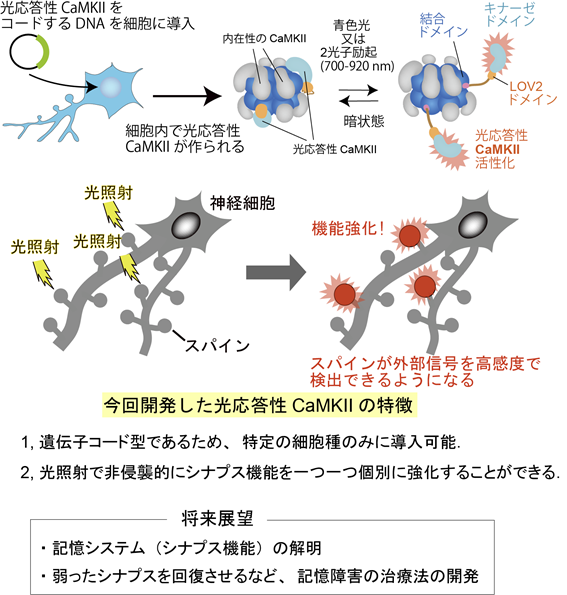
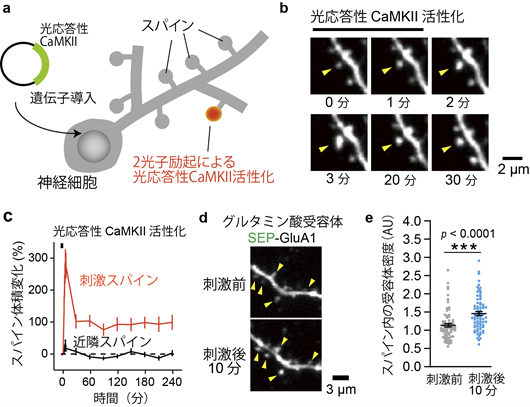
図2
a, 光応答性CaMKIIをコードするDNAを海馬スライスの神経細胞に導入。シナプス(スパイン)内で2光子励起(レーザー波長900 nm)で光応答性CaMKIIを活性化させる。
b, 光応答性CaMKIIを活性化させたスパインの画像。矢印で示したスパインの体積が増大していることに着目。
c, 光応答性CaMKIIを活性化させたスパインの体積変化のタイムコース(赤色)。体積変化は4時間以上持続する。刺激を行っていない近隣のスパイン(黒)では体積は変化しない。
d, 光応答性CaMKIIと蛍光グルタミン酸受容体(SEP-GluA1)をコードするDNAを海馬スライスの神経細胞に導入。2光子励起レーザー蛍光顕微鏡(920 nm)で神経細胞を観察しながら、光応答性CaMKIIを同時に活性化させた。スパインの輝度が高くなっている(受容体が増加)ことに注目。
e, 光応答性CaMKII活性化前後のグルタミン酸受容体の密度変化。光刺激後にスパインでの受容体密度が増加する。
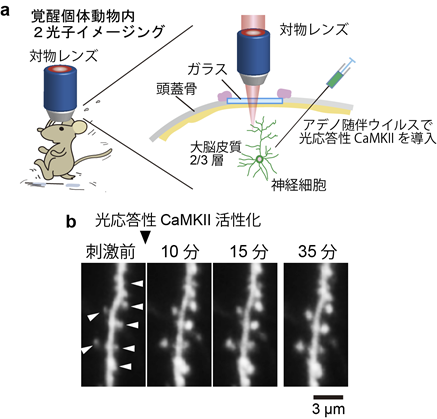
図3
a, 光応答性CaMKIIと黄緑色蛍光タンパク質(Clover)をアデノ随伴ウイルスによってマウスの大脳皮質に導入する。
b, 覚醒状態のマウス脳内を2光子顕微鏡で可視化。10マイクロメートル程度の領域を900 nm(2光子励起)で照射することによりスパイン体積の増大を誘起することができた。スパイン体積増大はシナプスの機能(細胞間の信号を流れ易くする)と直接関係がある。
本研究では、生きた動物内で脳神経細胞のシナプスの大きさや機能を1つずつ光操作することが可能な光応答性酵素の開発に成功しました。今後、この光応答性酵素を用いて記憶の仕組みを調べることができるだけでなく、弱ったシナプスを回復させるなど、記憶障害の治療法の開発が進むと考えられ、将来の光医療開発の指針となる画期的な成果であると考えられます。
Photoactivatable CaMKII induces synaptic plasticity in single synapses.
Akihiro AC. Shibata, Hiromi H. Ueda, Kei Eto, Maki Onda, Aiko Sato, Tatsuko Ohba, Junichi Nabekura, Hideji Murakoshi.
Nature Communications. 2021年2月2日電子版掲載
<研究について>
自然科学研究機構 生理学研究所 脳機能計測・支援センター
准教授 村越 秀治 (ムラコシ ヒデジ)
<広報に関すること>
自然科学研究機構 生理学研究所 研究力強化戦略室

自然科学研究機構 生理学研究所 研究力強化戦略室