|
パーキンソン病は脳内のドーパミンが不足することによって、動作緩慢、こわばり、ふるえなどの症状を示す神経難病です。脳内のドーパミンを補う薬であるL-ドーパを服用することにより、これらの症状は改善し、身体をスムーズに動かすことができるようになります。最初の数年間は薬でうまくコントロールできるのですが、10年も服用すると、身体が勝手に動いてしまう「L-ドーパ誘発性ジスキネジア」と呼ばれる運動障害が生じます。この副作用によってL-ドーパの服用が困難になり、パーキンソン病治療における大きな問題となっています。これまで、L-ドーパによりどのように脳の活動が変化してジスキネジアが生じるのか、詳しいメカニズムは分かっていませんでした。 今回、自然科学研究機構 生理学研究所のデウィ ワヒュー インドリアニ(Dwi Wahyu Indriani)研究員、佐野裕美助教、南部篤教授らのグループは、ジスキネジアの出現と神経活動との関係からジスキネジアが生じるメカニズムを明らかにしました。本研究結果は、Journal of Neuroscience誌(2021年3月24日号)に掲載されます。 |
パーキンソン病は脳内の黒質緻密部と呼ばれる領域にあるドーパミン神経細胞が減少し、動作緩慢、こわばり、ふるえなどの運動症状やうつ、睡眠障害、便秘などの非運動症状を示す疾患です。日本では10万人以上の患者さんがいると考えられ、超高齢社会を迎えて大きな医療、社会問題となっています。治療には、脳内で不足しているドーパミンを補充するL-ドーパと呼ばれる薬を服用することにより、これらの症状が改善します。L-ドーパは効果的にパーキンソン病を治療することができます。最初の数年間はうまくコントトールできるのですが、10年も服用すると、「L-ドーパ誘発性ジスキネジア」と呼ばれる身体が勝手に動いてしまう運動障害が生じます。この副作用によってL-ドーパの服用が困難になり、パーキンソン病治療における大きな問題となっています。しかし、L-ドーパの長期服用により、脳の活動がどのように変化した結果、ジスキネジアが生じるのかは明らかにされていませんでした。
通常、運動の情報は、大脳皮質から運動の指令を受け、大脳基底核のハイパー直接路、直接路、間接路、と呼ばれる3種類の経路で処理されます。そしてその情報が大脳基底核の出力部である黒質網様部へと伝えられ、運動が制御されます(図1)。
大脳皮質を刺激して運動の指令を出すと、正常であれば、黒質網様部で三相性(興奮−抑制−興奮)の反応が見られます(図2左)。早い興奮(図2ピンク色部分)はハイパー直接路を介して現在の運動のリセットに関わっており、抑制(図2青色部分)は直接路を介して運動へのブレーキを弱め運動を引き起こし、遅い興奮(図2緑色部分)は間接路を介して運動のストップに関与することがわかっています。パーキンソン病では、直接路と間接路のバランスが崩れており、黒質網様部の抑制がほとんどなくなることから、運動を引き起こせない、すなわち運動緩慢になると考えられています(図2中央)。
しかし、ジスキネジア発症時に黒質網様部でどのような反応が見られるのか、どの経路が関係しているのか、分かっていませんでした。そこで研究グループは、ジスキネジア発症時の黒質網様部の神経活動を調べるため、まずドーパミン神経細胞を壊す薬剤を与えてパーキンソン病モデルマウスを作製しました。そしてL-ドーパを10日間以上投与して、手足、口に過剰な運動であるジスキネジアが生じる事を確認しました。次にこれらのマウスの黒質網様部における神経活動を記録しました。その結果、抑制が増強し、遅い興奮がほとんどなくなり二相性(興奮−抑制)の反応となっていることが分かりました(図2右)。これは、運動を引き起こす信号伝達が増強するとともに、運動をストップする信号伝達が減弱していることを示しており、その結果、意図しない運動が引き起こされ、またストップが困難な状態、すなわちジスキネジアを生じたと考えられます。これらの結果から、ジスキネジアには直接路からの信号の増強と間接路からの信号の減弱が関わっている可能性が示唆されました。
南部教授は、「今回の研究で、これまでに明らかにされていなかったL-ドーパ誘発性ジスキネジアが生じる神経生理学的なメカニズムが分かりました。直接路や間接路に介入することにより、L-ドーパ誘発性ジスキネジアを抑える可能性がわかり、L-ドーパ誘発性ジスキネジアの治療法の開発につながることが期待できます」と話しています。
本研究は文部科学省科学研究費補助金(新学術研究領域「オシロロジー」「適応回路シフト」、基盤研究A、国際共同研究加速基金)、CREST「オプトバイオ」の補助を受けて行われました。
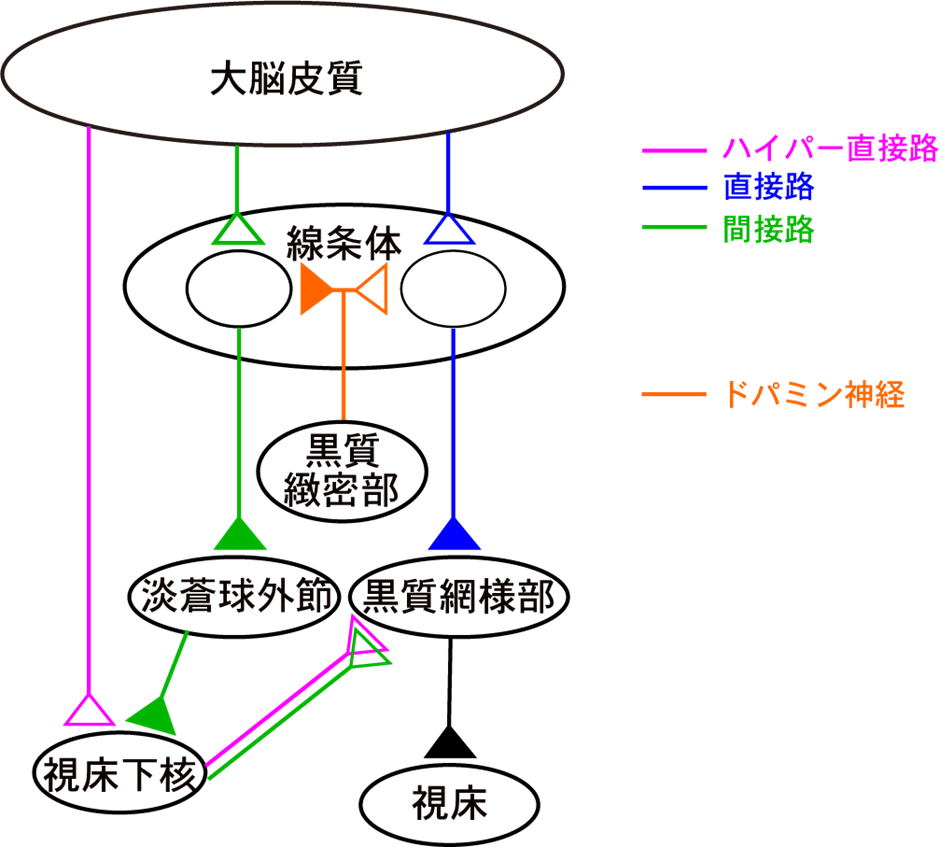
大脳基底核は大脳皮質からの指令を、ハイパー直接路、直接路、間接路と呼ばれる3つの経路で出力部である黒質網様部へと伝え運動を制御しています。
パーキンソン病では黒質緻密部のドーパミン神経細胞が減少し、直接路と間接路からの情報のバランスが崩れて動作緩慢、こわばり、ふるえなどが現れると考えられています。
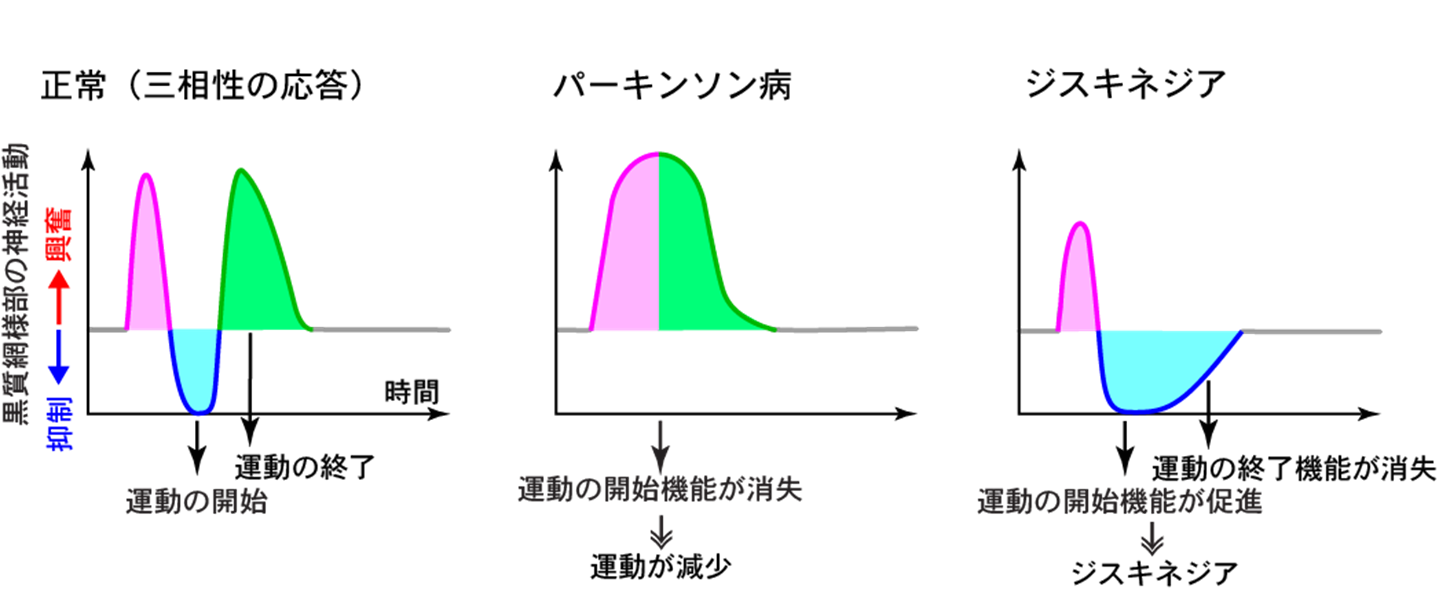
黒質網様部からの神経活動記録。正常では、興奮−抑制−興奮の三相性の応答が認められます。パーキンソン病モデルでは興奮のみ、ジスキネジアでは興奮−強い抑制という反応が認められました。抑制は運動の開始に、遅い興奮は運動の終了に作用することから、ジスキネジアは運動の開始機能の促進と終了機能の消失によって引き起こされると考えられます。
L-ドーパはパーキンソン病に対して有効な薬ですが、長期間服用すると運動が過剰になるL-ドーパ誘発性ジスキネジアという副作用を示すようになります。今回、L-ドーパ誘発性ジスキネジアが起こる神経メカニズムがわかったので、それを抑えることにより、L-ドーパ誘発性ジスキネジアを軽減させる創薬戦略への応用が期待できます。
Abnormal cortico-basal ganglia neurotransmission in a mouse model of L-DOPA-induced dyskinesia.
Indriani Dwi Wahyu, Satomi Chiken, Taku Hasegawa, Hiromi Sano & Atsushi Nambu
Journal of Neuroscience. 2021年3月24日号掲載(紙面版)
※オンライン版は掲載済
<研究について>
自然科学研究機構 生理学研究所 生体システム部門
助教 佐野 裕美(サノ ヒロミ)
教授 南部 篤 (ナンブ アツシ)
<広報に関すること>
自然科学研究機構 生理学研究所 研究力強化戦略室

自然科学研究機構 生理学研究所