内容
|
TRPM2は温かい温度で活性化するイオンチャネルですが、TRPM2は体温に保たれた組織および細胞に発現するため、体温付近の温度での機能が何らかのメカニズムで調節されると考えられます。しかし、TRPM2の温度感受性が生体内で変化する詳しいメカニズムはほとんどわかっていませんでした。今回、自然科学研究機構 生理学研究所の加塩麻紀子特任准教授、愛知医科大学の増渕悟教授らのグループは、TRPM2が、どれほどの温度に達すると活性化するかには、細胞内のカルシウムイオン濃度と、TRPM2リン酸化(注1が関わっていることを明らかにしました。本研究結果は、The journal of Physiology誌(2022年9月1日号)に掲載されました。 |
われわれ恒温動物の体温は一定の範囲に保たれており、多くの生物の体内では、温度感受性TRPチャネルが温度を感じる働きをしています。なかでも、TRPM2チャネルは体温により活性化し、深部体温に保たれた様々な臓器(脳、肝臓、脾臓、膵臓、免疫細胞など)で機能しています。TRPM2は、体温に保たれた組織および細胞に発現することから、体温下での機能が何らかのメカニズムにより調節されることで体温センサーとして機能していると考えられますが、どのようにして温度を感じ取っているのか、そのメカニズムは分かっていませんでした。
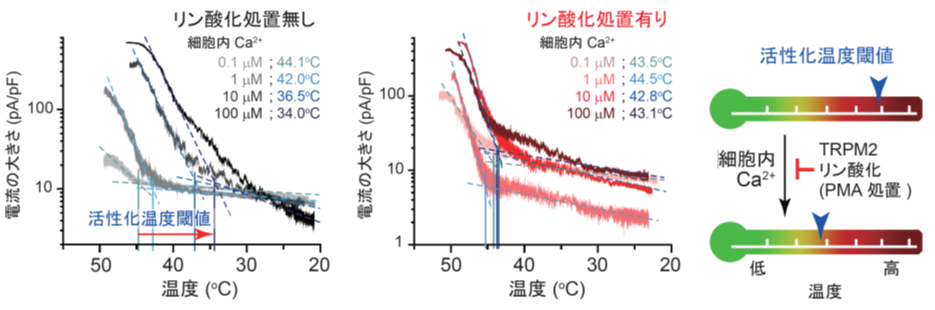
まず研究グループは、カルシウムイオン濃度に着目。細胞内に存在するカルシウムイオン濃度を変化させた時に、TRPM2の活性化を起こす温度に変化があるのか、検証しました。その結果、カルシウムイオン濃度が低い時は、約44℃という高い温度まで上げないとTRPM2は活性化しませんでしたが、カルシウムイオン濃度が高い時には34.0℃という低めの温度で活性化することがわかりました。これらの結果は細胞内のカルシウムイオン濃度に依存してTRPM2を活性化させる温度の閾値が変化することを示しています。(図1左)。
さらに、詳細にTRPM2の働きを調べた結果、TRPM2はPKCというタンパクリン酸化酵素(
注2によってリン酸化を受けることが明らかになりました。そこで、TRPM2リン酸化によって活性化を起こす温度に変化があるかを調べました。TRPM2リン酸化をコントロールするために、TRPM2をリン酸化するPKCを活性化させる薬剤の投与を行いました(PMA処理)。この処理を行うことで、PKCを活性化させ、リン酸化を促進させることができます。実験の結果、PMA処置によってリン酸化が進むと、カルシウムイオン濃度に関係なく、およそ42℃~44℃という高い温度にならないと活性化しないことが明らかになりました(図1中央)。この結果は、TRPM2のリン酸化が、細胞内カルシウムイオンの作用を打ち消す働きをすることを示しています(図1右)。
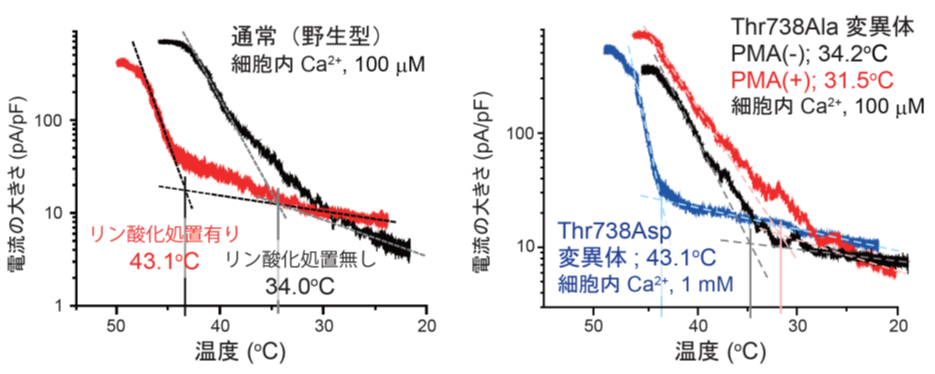
さらに、詳しい分子メカニズムの解析を行い、TRPM2を活性化させる温度の調節に関わるアミノ酸残基を明らかにしました。通常のTRPM2ではリン酸化を起こすPMA処置を行うと、高い温度でないと活性化がおこりませんが(図2左)、TRPM2のアミノ酸残基(
注3の一つであるスレオニンを、リン酸化が起こらなくなるアラニンに置換した変異体(Thr738Ala)では、PMA処置を行っても、リン酸化が起こっていないときと同程度の低い温度で、活性化が起こりました(図2右、黒および赤トレース)。さらに、同じアミノ酸残基を、リン酸化を疑似的に再現できるアスパラギン酸に置換した変異体(Thr738Asp, Asp;アスパラギン酸)では、やはりTRPM2がリン酸化された時と同程度の高い温度でないと活性化が起こりませんでした(図2右、青トレース)。これらの結果より、Thr738はTRPM2の活性化を引き起こす温度を調節する役割を担うアミノ酸である可能性が示唆されます。
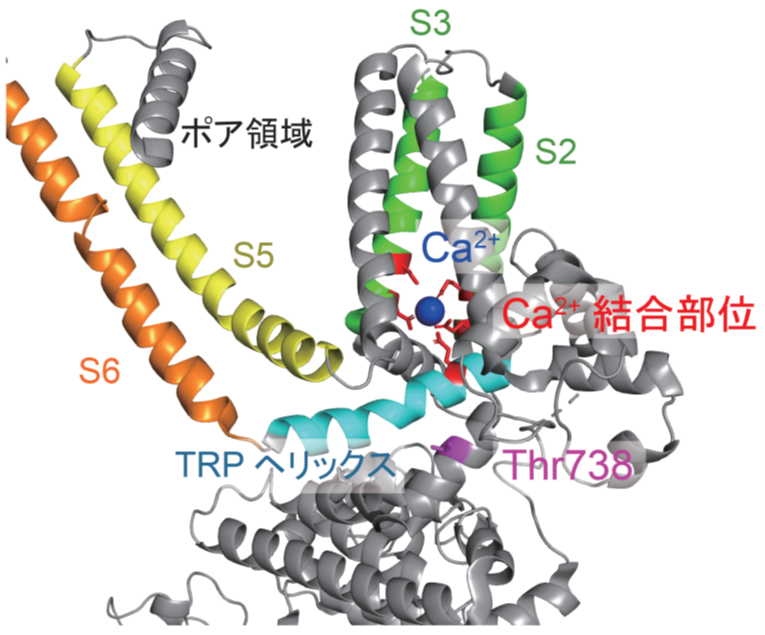
今回同定したアミノ酸残基(Thr738)は、TRPM2の細胞膜領域に存在するカルシウムイオン結合部位の近くに存在していたことから(図3)、カルシウムイオン結合による効果に影響を与え、TRPM2の活性化を起こす温度に変化がもたらされたと考えられます。
加塩特任准教授は「今回の研究で、これまで温度感受性TRPチャネルがどのようにして温度による活性化を受けるのか、またその活性化を引き起こす温度がどのように決まっているのかはほとんどわかっていませんでした。今回の発見は、温度依存性TRPチャネルが温度という物理刺激で活性化する分子メカニズムの解明につながる成果だと期待できます。」と話しています。
本研究は文部科学省科学研究費補助金、日本医学会総会記念医学振興基金、武田科学振興財団の補助を受けて行われました。
今回の発見
-
TRPM2がどれほどの温度になると活性化するかは、細胞内のカルシウムイオン濃度に依存して変化していることを明らかにしました。
-
TRPM2のリン酸化が進むと、カルシウムイオンの作用を打ち消して、TPRM2が活性化する最低温度を上昇させることを発見しました。
-
TRPM2が活性化する温度を調節する際に重要な単一アミノ酸(Thr738)を明らかにしました。
用語解説
注1)リン酸化:タンパクにリン酸基というタグのようなものが付加される反応。リン酸基が付加されたり、除去されたりすることでタンパクの機能が調節される。生体内で起こる重要なタンパク機能調節メカニズム。
注2)タンパクリン酸化酵素:タンパクのリン酸化を促進する働きをする酵素。生体内での様々な刺激によって活性化し、タンパクにリン酸基を付加する。
注3)アミノ酸残基:生体内のタンパクはアミノ酸がペプチド結合(隣り合うアミノ酸間で水分子が除かれることで形成される結合方法)することで構成されている。水が取り除かれて残ったアミノ酸の構造をアミノ酸残基という。アミノ酸残基ごとに異なる性質を示し、リン酸化を受けるアミノ酸残基の一つにスレオニン残基がある。
図1 TRPM2が活性化する温度は、細胞内カルシウムイオン濃度とTRPM2リン酸化に影響を受けて変化する
(左)細胞内カルシウムイオンの濃度を変化させた場合にTRPM2が活性化する温度とTRPM2の電流の大きさ;温度が上昇すると(横軸右から左方向)TRPM2チャネルが活性化する―。細胞内のカルシウム濃度に依存して活性化する最低温度は低下した。
(中央)PMA処置を行いリン酸化が進んだ際の、TRPM2が活性化する温度とTRPM2の電流の大きさ;PMA処置により細胞内カルシウムイオンによるTRPM2の活性化温度閾値の低下が起こらなくなった。
(右)細胞内カルシウムイオンとTRPM2リン酸化によるTRPM2 活性化温度閾値調節機構の模式図;細胞内カルシウムイオン濃度上昇による閾値の低下にTRPM2リン酸化が拮抗することで閾値が調節される。
図2 TRPM2リン酸化の活性化温度調節にはThr738アミノ酸残基が関与する
(左)リン酸化処置無し((黒トレース)およびリン酸化処置有(赤トレース)におけるTRPM2が活性化する温度とTRPM2の電流の大きさ; リン酸化(PMA)処置によりTRPM2が活性化する温度は上昇した。
(右)スレオニンをアラニンに置換した変異体(Thr738Ala)およびスレオニンをアスパラギン酸に置換した変異体(Thr738Asp)における活性化の温度とTPRM2の電流の大きさ;スレオニン残基をアラニンに入れ替えること(Thr738Ala)により、PMA処置を行ってもリン酸化を行っていない時と同様の低い温度で活性化した。さらに、スレオニンのリン酸化を模した変異体(Thr738Asp, Asp;アスパラギン酸)は、PMA処置をした場合と同程度に高い温度で活性化した。
図3 TRPM2リン酸化による活性化温度の調節に関わるアミノ酸残基(Thr738)の立体構造配置
TRPM2単一サブユニットの立体構造を示す。膜貫通セグメント(S1-S6)とその中央に形成されるポア領域を含む細胞膜領域、その下に示した細胞質領域(一部のみ表示)からなる。Thr738残基(マゼンタ)は、細胞膜貫通領域(S2およびS3、緑)とTRPヘリックス(シアン)で形成されるカルシウムイオン(青)の結合部位(赤)の近くに位置する。
この研究の社会的意義
TRPM2チャネルは体温調節や温度センサーとして健康のために非常に重要な役割を担っています。そのため、TRPチャネルがどのようにして温度を感じとっているか、これまでにも精力的な研究がなされてきましたが、そのメカニズムは不明でした。本研究成果は、温度感受性TRPチャネルが如何にして温度による活性化を受けるのか、さらにその活性化温度閾値が決定する詳細なメカニズムの解明に道を開くものと期待されます。
論文情報
Protein kinase C (PKC)-mediated phosphorylation of TRPM2 Thr738 counteracts the effect of cytosolic Ca2+ and elevates the temperature threshold
Makiko Kashio, Satoru Masubuchi and Makoto Tominaga
The journal of Physiology. 2022年9月1日号
DOI: https://doi.org/10.1113/JP283350
お問い合わせ
<研究について>
自然科学研究機構 生理学研究所 細胞生理研究部門
特任准教授 加塩 麻紀子 (カシオ マキコ)
<広報に関すること>
自然科学研究機構 生理学研究所 研究力強化戦略室
愛知医科大学医学部事務部庶務課
リリース元


自然科学研究機構 生理学研究所
愛知医科大学
556