私たちの細胞は、多様なシグナルを用いて情報を処理しています。中でもイオンチャネルは、イオンを通すことで細胞の電気的信号を生み出す、生命活動に不可欠なたんぱく質です。イオンチャネルの一つであるTwo-pore channel (TPC) は、2種類の異なる刺激(膜電位と化学物質であるPIP2)を受け取ることができ、それによってイオンを通すゲートを開閉します。TPCには、ゲートの開閉がおもに膜電位によって決まるタイプ(TPC3)と、PIP2によるタイプ(TPC2)がありますが、この違いを生み出す詳細な機構はよくわかっていませんでした。今回、自然科学研究機構 生理学研究所の下村拓史助教らは、ゲートの開閉がおもに膜電位によって決まるTPC3において、まるでTPC2のようにPIP2結合によって開閉を決定できる特殊なモードが存在することを発見しました。この結果は、TPCのタイプの違いを生み出すメカニズムを明らかにしたものです。本研究結果は、Proceedings of the National Academy of Sciences of the United States of America誌(2023年2月1日号)に掲載されました。
|
背景
わたしたちの体が正常に働くためには、体内の電気的信号が不可欠です。例えば、脳や神経における情報伝達や、心臓の拍動にも電気的信号が使われており、これらの電気的信号はイオンチャネルと呼ばれるたんぱく質によって生み出されています(図1A)。イオンチャネルはゲートを開閉し特定のイオンのみを通すことで、細胞の内と外の電位差(膜電位)を生み出しています。イオンチャネルは種類によって、ゲートを開閉するきっかけとなる刺激が異なっており、膜電位を受けて活性化するもの(電位依存性イオンチャネル)や、化学物質で活性化するもの、温度や力により活性化するものなど様々なタイプが存在します。例えば、一般的な電位依存性イオンチャネルでは、膜電位の違いによって、ゲートを閉じる“down”状態と開ける“up”状態の2状態をとり、それによりイオンを通すかどうかが決まります(図1B)。
Two-pore channel (TPC)の特性
Two-pore channel (TPC) と呼ばれるイオンチャネルでは、膜電位と化学物質(PIP2注1と呼ばれる小分子化合物)の両方を感知してゲートを開閉できます(図1C)。異なる2つの刺激を感知するために、TPCは2つの機能単位を持つユニークな分子構造をしています。1つ目の部位(DI)はPIP2を結合する一方、2つ目の部位(DII)は膜電位を感知する電位センサーを持っており、特にDIIの4番目のヘリックス(DII-S4)がその実体です。
またTPCにはTPC1、TPC2、TPC3という3つのタイプがあり、PIP2と膜電位に対して違う反応を示します。例えば、TPC3は膜電位変化のみでゲートを開くことができ、PIP2は補助的な役割を果たします。一方、TPC2はTPC3と同様に2つの機能単位を持つにもかかわらず、膜電位を必要とせず、PIP2のみで開きます。全体として非常によく似たかたちを持つこれらのタイプが、どのようにしてPIP2と膜電位に対して異なる応答を示すことができるのかについて、これまで十分には理解されていませんでした。
今回の研究結果
研究グループは、TPCの電位センサーは、PIP2の感知に対応するために、一般的な電位依存性イオンチャネルにはない特殊な状態を備えているのではないかと考えました。そこで、おもに膜電位により活性化するTPC3のDII-S4に蛍光分子をとりつけ、チャネルの状態間の変化を直接測定注2しました。その結果、TPC3のDII-S4は“up”と“down”の2つの状態の間に、さらにintermediate (中間)”の状態を取ることがわかりました(図2)。通常、この中間状態は一過的なものであり、ゲートの開口にはつながりません。しかし、アミノ酸変異注3により、この中間状態を人為的に固定化すると、PIP2に結合しているときにだけゲートが開く事を発見しました。これは、おもに膜電位によってその開閉が決定されているTPC3を、PIP2によって開閉するタイプに転換できた、ということを意味します。また、PIP2のみで開閉できるタイプであるTPC2の場合、水素結合注4により、もともとこの中間状態が安定化されていることがわかりました。
このことから、TPCは、DII-S4のup/ down状態の切り替えによりゲートを開閉する典型的なモードに加え、PIP2による開閉に対応した“隠しモード”ともいえる中間状態を備えた、ユニークな電位感受性イオンチャネルであることがわかりました。本研究結果は、1種類のイオンチャネルが、化学物質と膜電位という性質の大きく異なる刺激に対応するための、これまでに知られていなかった分子メカニズムを明らかにしたものです。
本研究は文部科学省科学研究費補助金、武田科学振興財団、住友財団の補助を受けて行われました。
今回の発見
-
おもに膜電位の変化により開閉するタイプのTPCにおいて、膜電位感知に重要な部位であるDII-S4が、下がった状態、上がった状態の他に、一過的な中間状態をとりうることが新たにわかりました。
-
中間状態は、小分子化合物であるPIP2の有無によってイオンを通すゲートを開閉することができる、特殊な状態であることがわかりました。
-
もともとPIP2によって開閉するタイプのTPCでは、中間状態をとりやすいようになっていることがわかりました。
用語解説
注1) PIP2:フォスファチジルイノシトールビスリン酸。生体内の重要なシグナル因子であり、その合成・分解を通じて多様な生理機能を制御する。2個のリン酸基が付与されるイノシトール環の位置により、PI(4,5)P2やPI(3,5)P2などの違いがあり、TPCはおもに後者を結合する。
注2) 蛍光分子による動きの測定:膜電位固定下化学蛍光測定法とよばれ、目的タンパク質の特定のアミノ酸に蛍光分子をラベルし、その蛍光変化をイオンチャネル電流と同時に測定し比較をおこなう。蛍光分子の強度はまわりの環境によって変化するため、ラベルした位置の構造変化が蛍光変化として捉えられる。
注3) アミノ酸変異導入:タンパク質は多数のアミノ酸が連なったものであり、その種類・順序は対応する遺伝子のDNA配列により決定されている。変異させたいアミノ酸に対応するDNA配列をもつ遺伝子を細胞に導入することで、ねらった変異タンパク質を得ることができる。
注4) 水素結合:タンパク質でよくみられる分子間相互作用の一つで、水素原子と近接する酸素原子あるいは窒素原子との間で形成される。
図1 一般的な電位依存性イオンチャネルとTPCの違い
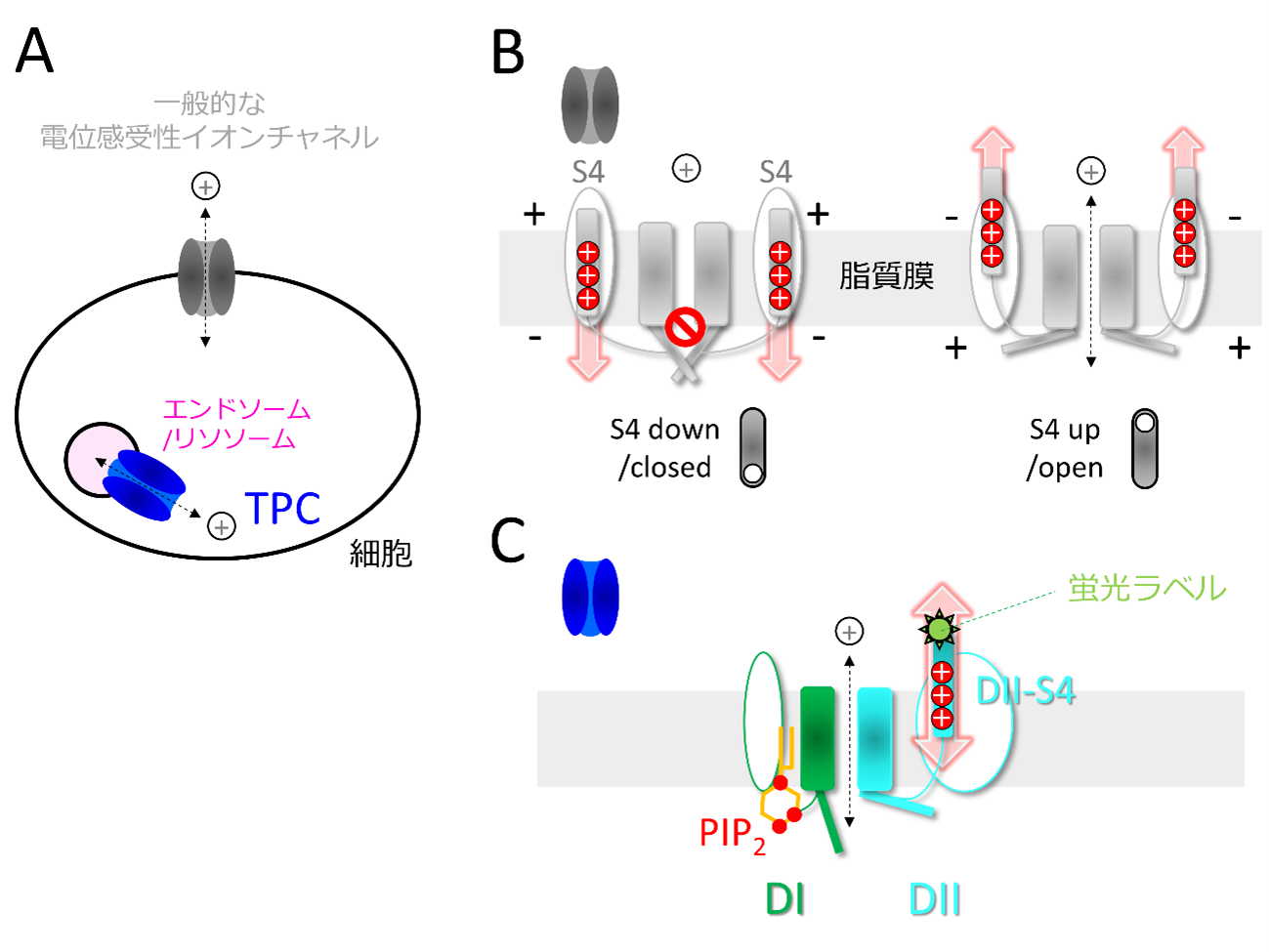
(A) 多くの電位依存性チャネルは細胞内外を区切る細胞膜上に存在しているが、TPCは細胞内小器官であるエンドソームやリソソームの膜上に存在する。
(B) 一般的な電位依存性カチオンチャネルの振る舞い。膜電位が変化すると、S4が膜内を上下に動いてゲートを開閉する。S4は正(+)に帯電したアミノ酸を複数持っており、これにより膜電位の変化を感知できる。
(C) TPCの分子構造の模式図。膜電位はDIIのS4ヘリックスにより感知され、DIはPIP2の結合を担う。これらはそれぞれ中央のゲート開閉を制御する。DII-S4の状態をとらえるため、蛍光分子をDII-S4に取り付けて解析を行った。
図2 TPCにおける中間状態の存在と、それによるPIP2依存的な開閉
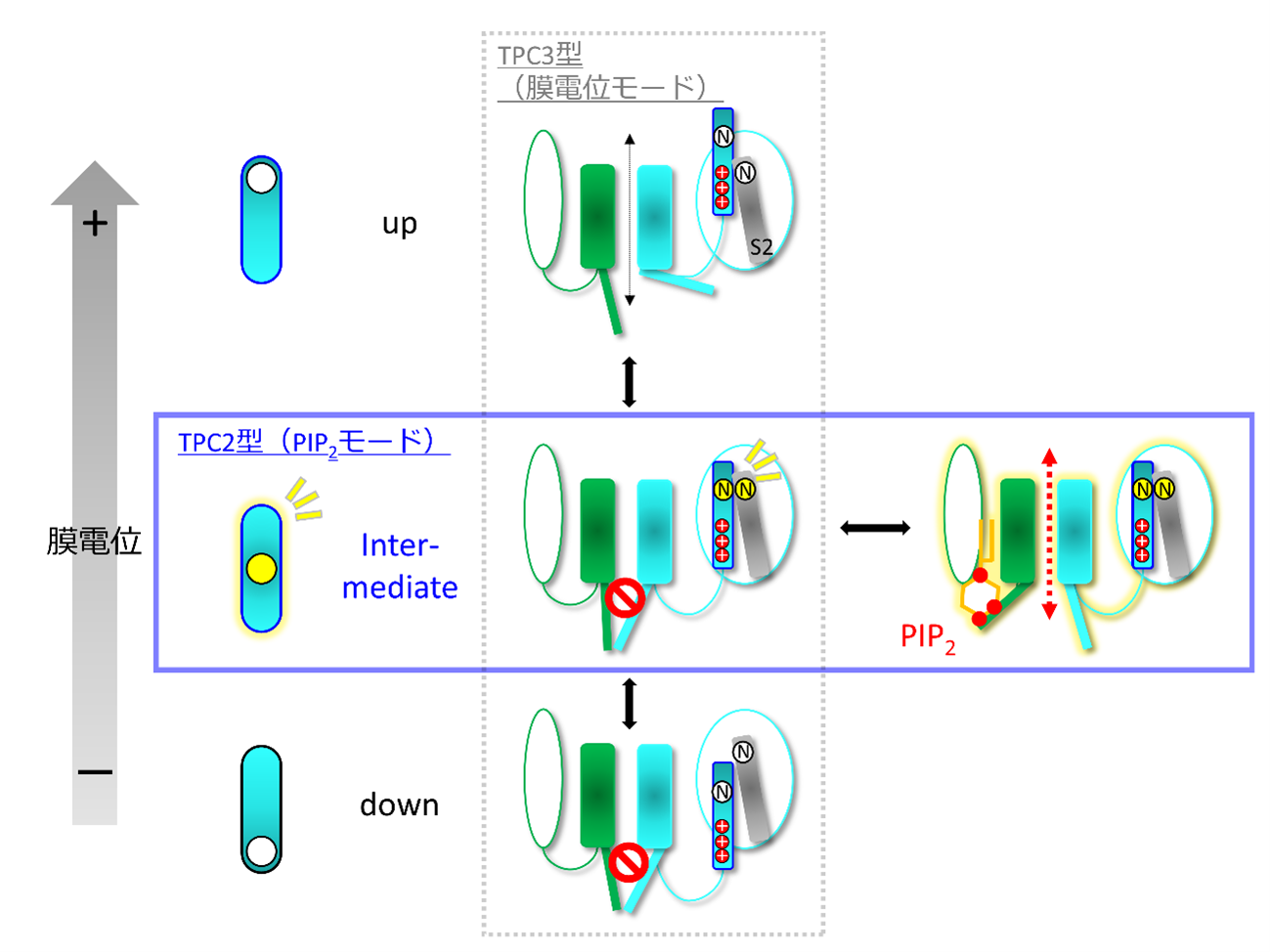
上下方向は、一般的な電位依存性イオンチャネルにもみられる、S4が膜電位に応じてupまたはdownを取り、ゲートを開閉するモードをあらわす。TPCは、これに加えて中間状態(intermediate)をとることができ、このときにPIP2が結合するとゲートが開けるようなモードも存在することを明らかにした。(N)は、TPC3で中間状態を安定化するためにアミノ酸変異を導入した位置であり、TPC2の場合はこのペアは水素結合により、もともと中間状態をとりやすいアミノ酸になっている。
この研究の社会的意義
TPCはリソソームやエンドソームなどの細胞内小器官に存在し、ナトリウムイオンやカルシウムイオンの透過を通じてその機能を制御しており(図1A)、アルツハイマー病への関与の他、新型コロナウィルスやエボラウィルスなどの感染においても重要な役割を果たしています。本研究の成果は、これらの重要な小器官のはたらきを制御できるような薬剤の開発につながることが期待されます。
論文情報
Conformational rearrangements in the second voltage sensor domain switch PIP2- and voltage-gating modes in two-pore channels.
Takushi Shimomura, Kiichi Hirazawa, Yoshihiro Kubo.
Proceedings of the National Academy of Sciences of the United States of America. 2023年 2月1日
DOI:
doi.org/10.1073/pnas.2209569120
お問い合わせ先
<研究について>
自然科学研究機構 生理学研究所 神経機能素子研究部門
助教 下村拓史 (シモムラタクシ)
<広報に関すること>
自然科学研究機構 生理学研究所 研究力強化戦略室
リリース元

自然科学研究機構 生理学研究所
552


