名古屋市立大学大学院医学研究科脳神経科学研究所の澤本和延教授(生理学研究所兼任)、大野雄也(同大学院博士課程4年)、中嶋智佳子(同特任助教)、および同志社大学脳科学研究科の金子奈穂子教授らの研究グループは、東京医科歯科大学、東京農工大学、バレンシア大学の研究者と共同で、傷害を受けたマウスの脳を再生させるバイオマテリアルを開発しました。
哺乳類の脳では出生後も特定の領域で新しく神経細胞が産生され続け、脳の傷害時には、新生ニューロンは傷害部位へ移動し、損傷により失われたニューロンを補うことで脳の再生に寄与しますが、効率的な移動に必要な足場となる細胞が少ないこともあり、十分な機能回復には至りません。
同グループはこれまでに、新生ニューロンの移動を促進すると、機能回復が得られることを発見し、足場となる人工物(バイオマテリアル*1)を移植することで、新生ニューロンの移動を促進する研究を行ってきました。
本研究では、新生ニューロンの移動に関わる細胞接着分子*2の細胞外領域全体を組み込んだ新しい超分子*3バイオマテリアルを開発しました。このバイオマテリアルは水に溶けるため、細い針を使って、脳に大きな損傷を与えることなく様々な部位に注入することができます。注入された後、脳組織の中でたくさんの分子が集まって、線維状の構造を形成し、ゲル化します。
傷害を受けたマウスの脳内にこの新しいバイオマテリアルを注入することによって、脳内に形成された人工足場が新生ニューロンの移動を促進し、再生されるニューロンを増やし、運動機能を回復させることに成功しました。
細胞接着分子の細胞外領域全体を組み込んだ超分子を用いて神経再生に成功したのは世界初であり、また今回の技術を応用して、様々な分子を組み込んだ足場を体内に形成させることができれば、脳以外の疾患の治療にも用いることができる可能性があります。
本研究成果は、2023年2月2日に、科学誌「Biomaterials(バイオマテリアルズ)」に掲載されます。(1月17日にJournal pre-proofとしてWeb掲載済)
研究のポイント
・傷害されたニューロンを再生させ、十分な機能回復を得る方法は現在のところ存在しません。
・新生ニューロンは、脳傷害時には傷害部位へ移動し、失われたニューロンを補うことで神経再生に関わりますが、傷害による機能障害を回復させるには不十分です。
・本研究では、新生ニューロンの移動に関わる細胞接着分子の細胞外の領域全体を組み込み、組織注入後にゲル化する液状のバイオマテリアルを開発しました。
・このバイオマテリアルは脳組織への影響が少ない非常に細い注射針で様々な部位に注入可能で、注入部位への新生ニューロンの移動を促進することが出来ました。
・マウス脳の傷害部位に再生されるニューロンを増加させ、運動機能を回復させることに成功しました。
・細胞接着分子の細胞外領域全体を組み込んだバイオマテリアルを使って神経再生に成功した世界初の研究であり、同技術を用いてバイオマテリアルに様々な分子を組み込むことで応用の拡大が期待できる重要な成果です。
用語解説
*1バイオマテリアル:生体に移植する素材のこと。古くは非生体組織のことを意味し、人工関節のように移植後長期間生体内で機能するものや、今回のように移植された組織と相互作用し再生を促した後に分解されるものなど多岐にわたる。さらに、近年は培養した細胞など生きた組織も広義のバイオマテリアルに定義される。
*2 細胞接着分子:細胞が他の細胞や細胞外の物質と相互作用するときに働く分子。情報伝達、器官形成、細胞移動など細胞の様々な活動において重要な役割を果たす。
*3 超分子:分子間相互作用によって分子同士が自己集合できる分子のこと。超分子をデザインすることで、形成されるバイオマテリアルの形状が変えられる。また任意の機能を有するタンパク質分子をバイオマテリアルに組み込むことも可能である。
背景
脳梗塞などの傷害が起こると、新生ニューロンは傷害部位へ移動し再生に寄与しますが、神経機能の回復には不十分です。同グループはこれまでに新生ニューロンの移動を促進することにより神経機能が回復することを発見し、足場となり新生ニューロンの移動をサポートするバイオマテリアルを用いた研究が、同グループを含めた複数のグループによって行われてきました。
足場となるバイオマテリアルは、生体内で足場として機能している細胞の性質や形を模倣するように設計されることが一般的です。同グループは以前、新生仔マウスの脳表面の傷害に対して、新生ニューロンの移動に関わる細胞接着分子であるNカドヘリンの細胞外領域を含んだスポンジ状のマテリアルの移植が、新生ニューロンの移動、機能回復を促進させることを発見しました。しかし固形のマテリアルは脳を傷つけずに深部に移植することはできないため、様々な脳疾患の治療に臨床応用するためには、移植しやすい形状ということも重要です。また、バイオマテリアルに大きな分子を組み込むことは技術的に難しく、細胞接着分子の一部を組み込んだバイオマテリアルの設計はこれまでに報告されていますが、一部のみでは接着分子としての機能が不十分な可能性が示唆されていました。
研究の成果
本研究では注入後に自己集合しゲル化するバイオマテリアル[(RADA)3-(RADG)] (以下mRADA)と、細胞接着分子Nカドヘリンの細胞外領域を組み込んだNcad-mRADAを開発しました。ゲル化したNcad-mRADAは表面にNカドヘリンの細胞外領域が並び、生体内で本来足場として機能する細長い細胞の突起を模倣した構造を取ります(図A、B)。
Ncad-mRADAは、脳表面に加えて脳深部の傷害部位にも新生ニューロンの移動を促進することができました(図A, B)。Nカドヘリンの細胞外領域を組み込んだNcad-mRADAは機能性タンパク質をバイオマテリアル内に安定的に保持できるため、一定期間、脳内で持続的にニューロンの移動をサポートする足場の供給が可能であることが考えられます。
次に、Ncad-mRADAの注入から1ヶ月後にニューロンの再生を評価しました。Ncad-mRADAの注入部付近を観察したところ、バイオマテリアルは分解しており、損傷が強い脳表近くにおいても多くの成熟ニューロンが再生していました(図C)。
最後に、傷害部に注入したNcad-mRADAが脳損傷による運動機能障害を改善するか、歩行機能テストを行って検証しました。Ncad-mRADAを脳傷害部に注入したマウスは、mRADAを注入したマウス、あるいは傷害後に治療を施さなかったマウスよりも歩行機能が回復し、正常なマウスと同レベルにまで改善しました(図D)。
これらの結果から、Ncad-mRADAは傷害脳における新生ニューロンの移動を促進する足場として効果的なバイオマテリアルであり、脳傷害後の神経再生を促進することが分かりました。
研究の意義と今後の展開や社会的意義など
脳に内在する幹細胞を用いた神経再生のアプローチには、安全性が高く治療に必要なコストが少ないなどのメリットがあります。よって、今回、超分子バイオマテリアルを用いることで自己の新生ニューロンによる神経再生に成功したことは、今後の再生医療の実現に向けた重要な成果と言えます。また、この技術は、細胞移植による再生医療にも応用できる可能性があります。mRADAはNカドヘリン以外の、様々な種類の大きな細胞接着分子をも組み込むことが可能です。さらに、誘引因子(遠くの細胞を引き寄せる因子)を混合することで直接接していない細胞にも作用するより効果的なバイオマテリアルを作ることが出来る可能性もあり、今後様々な応用が期待されます。
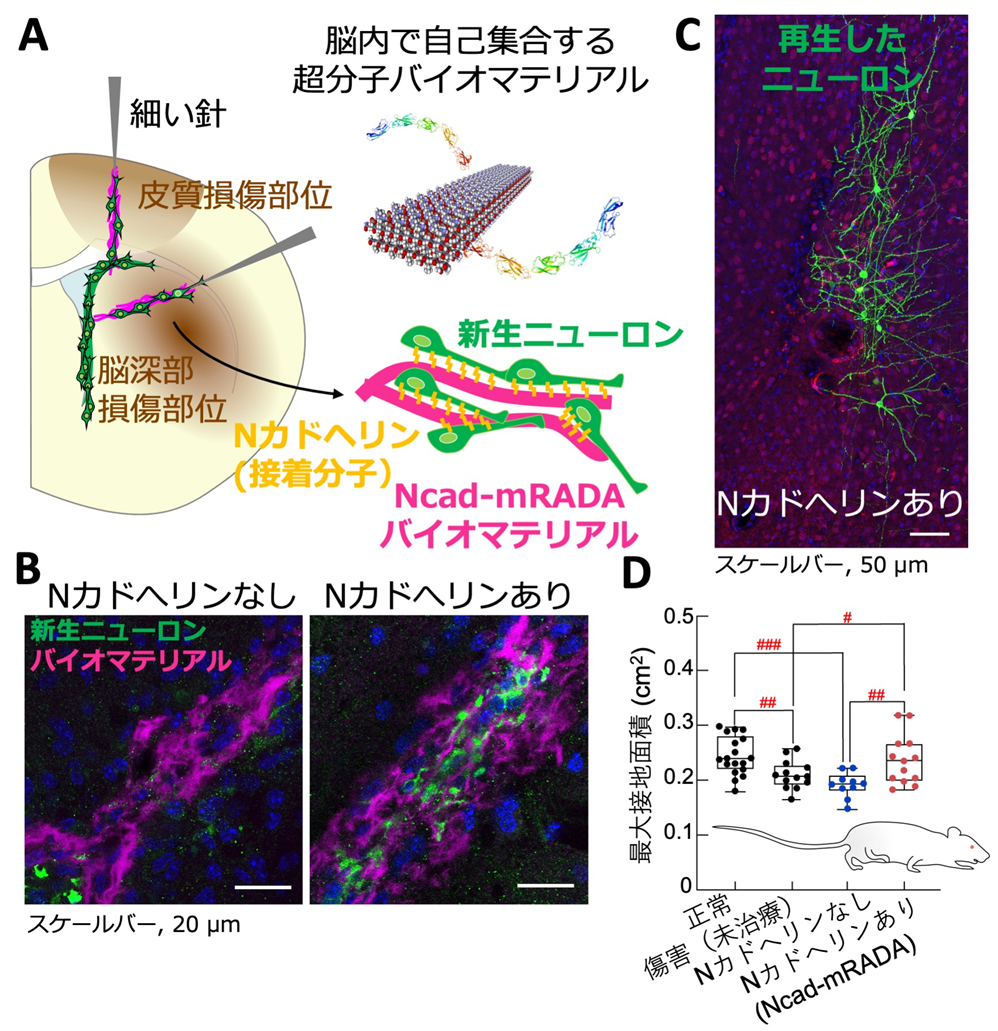
図:本研究の成果
© 2023 Ohno et al. Originally published in Biomaterials https://doi.org/10.1016/j.biomaterials.2023.122003
A. バイオマテリアルを脳に移植する実験の概要図。脳表と脳深部の傷害部位(茶)を一つの図で示している。細い針を用いて注入された液状のバイオマテリアル(マゼンタ)は、ゲル化しナノ繊維構造をとる。新生ニューロン(緑)と接着分子であるNカドヘリン(黄)が組み込まれたバイオマテリアル(Ncad-mRADA)は互いが有するNカドヘリンによって相互作用し、ニューロンの移動が促進する。
B. バイオマテリアル(マゼンタ)が注入された脳深部の傷害部位の顕微鏡撮影画像。Nカドヘリンがないバイオマテリアル(mRADA)を脳損傷部に注入しても移動した新生ニューロン(緑)はほぼないが(左)、Ncad-mRADAを注入すると新生ニューロンの移動が促進した(右)。
C. 大脳皮質傷害部にNcad-mRADAを注入して約1ヶ月後の脳切片の顕微鏡撮影画像。成熟ニューロン(緑)が傷害部に再生した。
D. 大脳皮質傷害から約1ヶ月後に施行したマウスの肢の最大接地面積による歩行テストの結果。障害が大きいほど最大接地面積は小さくなる。mRADAを注入したマウスは、傷害後に未治療であったマウスと同程度に値が低かった。一方、Ncad-mRADAを脳傷害部に注入したマウスの最大接地面積はほぼ正常マウスの値まで回復し、Ncad-mRADAは傷害脳の機能回復に有効であることが分かった。
研究助成
本研究は、日本医療研究開発機構(AMED)の再生医療実現拠点ネットワークプログラム「幹細胞・再生医学イノベーション創出プログラム」研究開発事業における「脳細胞の移動・再生促進技術の開発」(研究開発代表者:澤本 和延)、医療分野国際科学技術共同研究開発推進事業(戦略的国際共同研究プログラム)(研究開発代表者:金子 奈穂子)、および革新的先端研究開発支援事業(AMED-CREST)「生体組織の適応・修復機構の時空間的解析による生命現象の理解と医療技術シーズの創出」研究開発領域における研究開発課題「ニューロン移動による傷害脳の適応・修復機構とその操作技術」(研究開発代表者:澤本 和延)、国立研究開発法人科学技術振興機構(JST)創発的研究支援事業(研究開発代表者:金子 奈穂子)、文部科学省・日本学術振興会科学研究費補助金、三菱財団、武田科学振興財団、キヤノン財団などによる助成を受けて行われました。
論文タイトル
Amphiphilic peptide-tagged N-cadherin forms radial glial-like fibers that enhance neuronal migration in injured brain and promote sensorimotor recovery
著者
大野雄也a,b,1、中嶋智佳子a,1、味岡逸樹c,d、村岡貴博d,e、矢口敦也e、藤岡哲平b、秋本沙織c,d、松尾実咲a、Ahmed Lotfyf、中村小百合a、Vicente Herranz-Pérezg、José Manuel García-Verdugog、松川則之b、金子奈穂子a,h,2、澤本和延a,i,2
a 名古屋市立大学大学院医学研究科 脳神経科学研究所 神経発達・再生医学分野
b 名古屋市立大学大学院医学研究科 神経内科学
c 東京医科歯科大学 統合研究機構 脳統合機能研究センター (CBIR)
d 神奈川県立産業技術総合研究所 (KISTEC)
e 東京農工大学大学院 工学研究院 応用化学専攻
f Biotechnology and Life Sciences Department, Faculty of Postgraduate Studies for Advanced Sciences (PSAS), Beni-Suef University
g Laboratory of Comparative Neurobiology, Cavanilles Institute, University of Valencia, CIBERNED
h 同志社大学大学院脳科学研究科 神経再生機構部門
i 生理学研究所 神経発達・再生機構研究部門
1 共同筆頭著者 2 共同責任著者
掲載学術誌
学術誌名 Biomaterials(バイオマテリアルズ)
お問い合わせ先
<研究に関するお問い合わせ>
名古屋市立大学大学院医学研究科脳神経科学研究所 教授 澤本和延
〒467-8601 名古屋市瑞穂区瑞穂町字川澄1
Tel:052-853-8532 Fax:052-851-1898
E-mail:sawamoto@med.nagoya-cu.ac.jp
<報道に関するお問い合わせ>
名古屋市立大学 病院管理部経営課
自然科学研究機構 生理学研究所 研究力強化戦略室(広報)
同志社大学 広報部広報課
リリース元



公立大学法人 名古屋市立大学
自然科学研究機構 生理学研究所
同志社大学
3559



