神戸大学大学院理学研究科生物学専攻・次世代光散乱イメージング科学研究センターの塚本寿夫准教授と自然科学研究機構生理学研究所神経機能素子研究部門の久保義弘教授は、環形動物ゴカイ由来の自己不活性化する特性を持つ光受容タンパク質を利用して、多様な細胞応答の中でイオンチャネル応答を選択的に光で制御できる「精密バイアス光操作ツール」を開発しました。この新規ツールによって、光で生理機能をコントロールする「光遺伝学」がより発展することが期待できます。
本成果は2023年5月15日に米国科学アカデミー紀要(Proceedings of the National Academy of Sciences of the United States of America, PNAS)にオンライン掲載されました。
ポイント
-
光受容後すみやかに不活性化する、無脊椎動物ゴカイ由来の光受容タンパク質を用いて、特定の細胞応答を「狙いうち」して光で制御できる「精密バイアス光操作ツール」を開発した。
-
光刺激によって生体組織や細胞の機能を制御することで生物機能を解析する「光遺伝学」の発展や、疾患や創薬に関わる細胞応答についての理解を深めることにつながることが期待できる。
研究の背景
光受容タンパク質を細胞に導入し、細胞応答を光で人為的に操作する研究手法は近年爆発的に発展しており、「光遺伝学*1」という研究分野が確立されています。光遺伝学解析には、これまでは微生物由来のチャネルロドプシンが細胞応答を光で操作するためのツールとしてよく用いられてきましたが、最近では種々の動物が持つオプシンとよばれる光感受性Gタンパク質共役受容体(GPCRと略されます)*2も有用なツールとして注目されています。動物オプシンを用いると、チャネルロドプシンの場合よりも百倍〜数千倍弱い光でも細胞応答を誘起できる利点があります。その一方で、動物オプシンはGタンパク質や他のシグナルタンパク質を介して、イオンチャネルがイオンを通す電気応答や酵素が細胞内の物質を変換する代謝応答など多様な細胞応答を引き起こす(図1)ため、いったい何を操作しているのか不明確になる難点もありました。
研究の内容
今回の研究では、環形動物ゴカイ*3由来のc-opsin1というオプシンが持つ、紫外光(UV)刺激によって活性化され、黄色光刺激で不活性化あるいは光刺激を止めることで自己不活性化する特性に着目しました。c-opsin1は不活性化するまでの短時間だけGタンパク質を活性化するため、細胞応答の中でも数秒で生じる「速い電気応答」はしっかり誘起できるが、数分で起こる「遅い代謝応答」は小さいことを発見しました(図2)。つまり、c-opsin1はイオンチャネル応答と代謝応答の両方ではなく、イオンチャネル応答を「狙いうち」して光制御できることになります。このc-opsin1が持つ特性をさらに強化するために、Gタンパク質を介した細胞応答を加速できるRGS8というタンパク質を遺伝子工学によってc-opsin1と融合させた人工タンパク質を作製(図3)し、光によって生じる細胞応答を詳細に検討しました。その結果、この人工タンパク質はもとのc-opsin1と比べて、より速いイオンチャネル応答を引き起こし、代謝応答はほぼ全く引き起こさないことを見出しました(図2)。つまりこの人工タンパク質は、イオンチャネル応答を選択的かつ素早く光で駆動できる光操作ツールとしてはたらきます。言い換えれば、この新規ツールはいろいろな細胞応答を同時に駆動してしまう動物オプシンの光操作ツールとしての難点を克服したことになります。
今後の展開
GPCRがGタンパク質や他のシグナルタンパク質を介して誘起する多様な細胞応答は、種々の疾患や薬剤作用と連関するため、GPCRは主要な創薬ターゲットとなっています。GPCRに作用し、Gタンパク質のみあるいは他のシグナルタンパク質のみに由来する細胞応答を「狙いうち」すなわちバイアスをかけて駆動できる薬剤は「バイアス作動薬」と呼ばれ、新薬候補として注目されています(図4A)。しかし、さらに下流のGタンパク質が駆動する複数のシグナル経路の中で特定の応答にバイアスをかけることは困難でした。今回開発した光操作ツールは、その困難さを乗り越えた「精密バイアス光操作ツール」と呼ぶことができます(図4B)。今後この精密バイアスツールを活用することで、光遺伝学の発展やGPCRが関わる生理機能の理解につながることが期待できます。
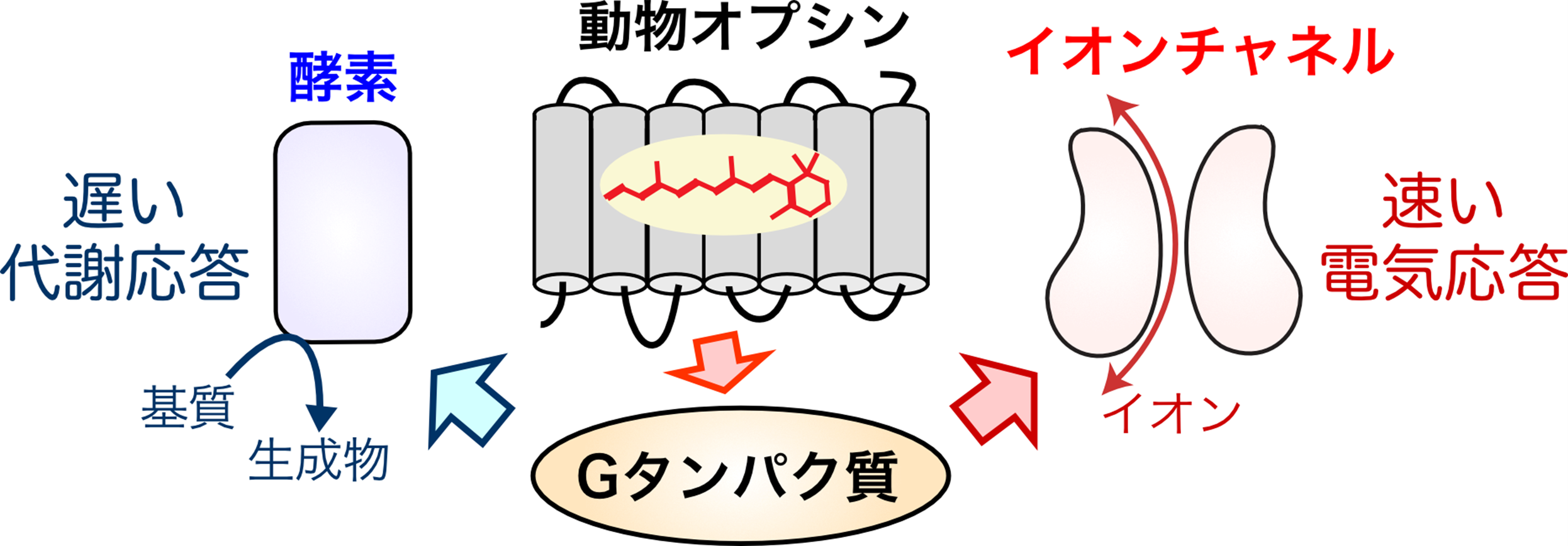 (図1)
(図1)
動物が持つ光受容タンパク質オプシンが駆動する多様な細胞応答の模式図
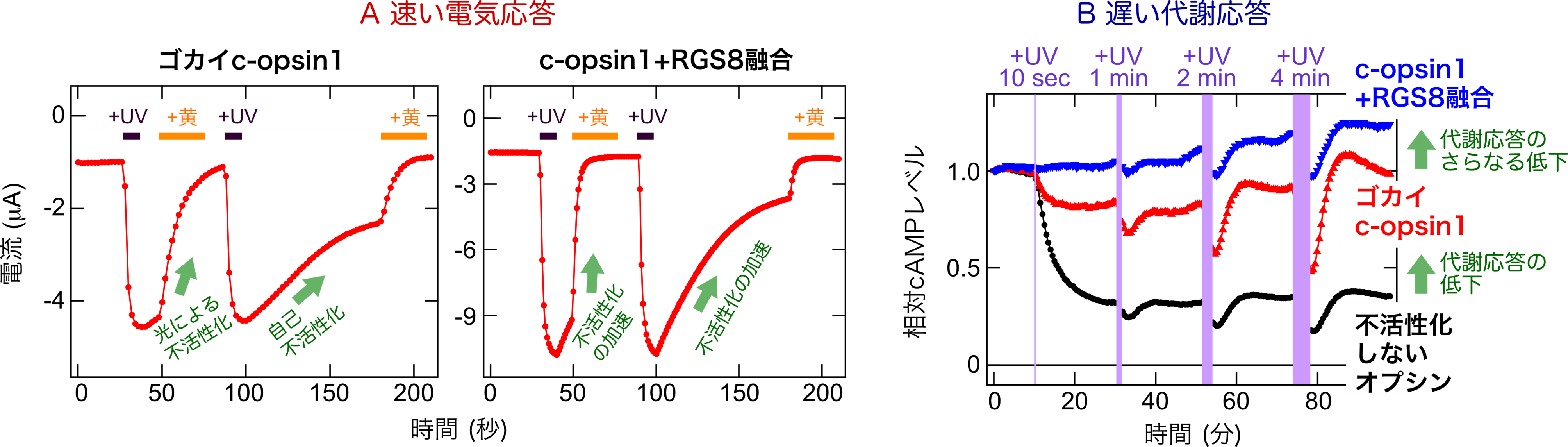 (図2)
(図2)
A:ゴカイc-opsin1およびc-opsin1+RGS8融合タンパク質による速い電気応答
両者とも紫外光(UV)刺激によって応答を誘起し、黄色光刺激か光を止めることで不活性化できる。c-opsin1+RGS8融合タンパク質では、不活性化が加速される。ここではGIRKというイオンチャネルを通る電流量を計測している。
B:ゴカイc-opsin1およびc-opsin1+RGS8融合タンパク質による遅い代謝応答
黒色で示した不活性化しないオプシンと比べて、赤色で示したc-opsin1は代謝応答が減少している。さらに、青色で示したc-opsin1+RGS8融合タンパク質については、ほぼ全く代謝応答を示さない。ここではcAMPというシグナル物質の減少をもたらす代謝反応を測定している。
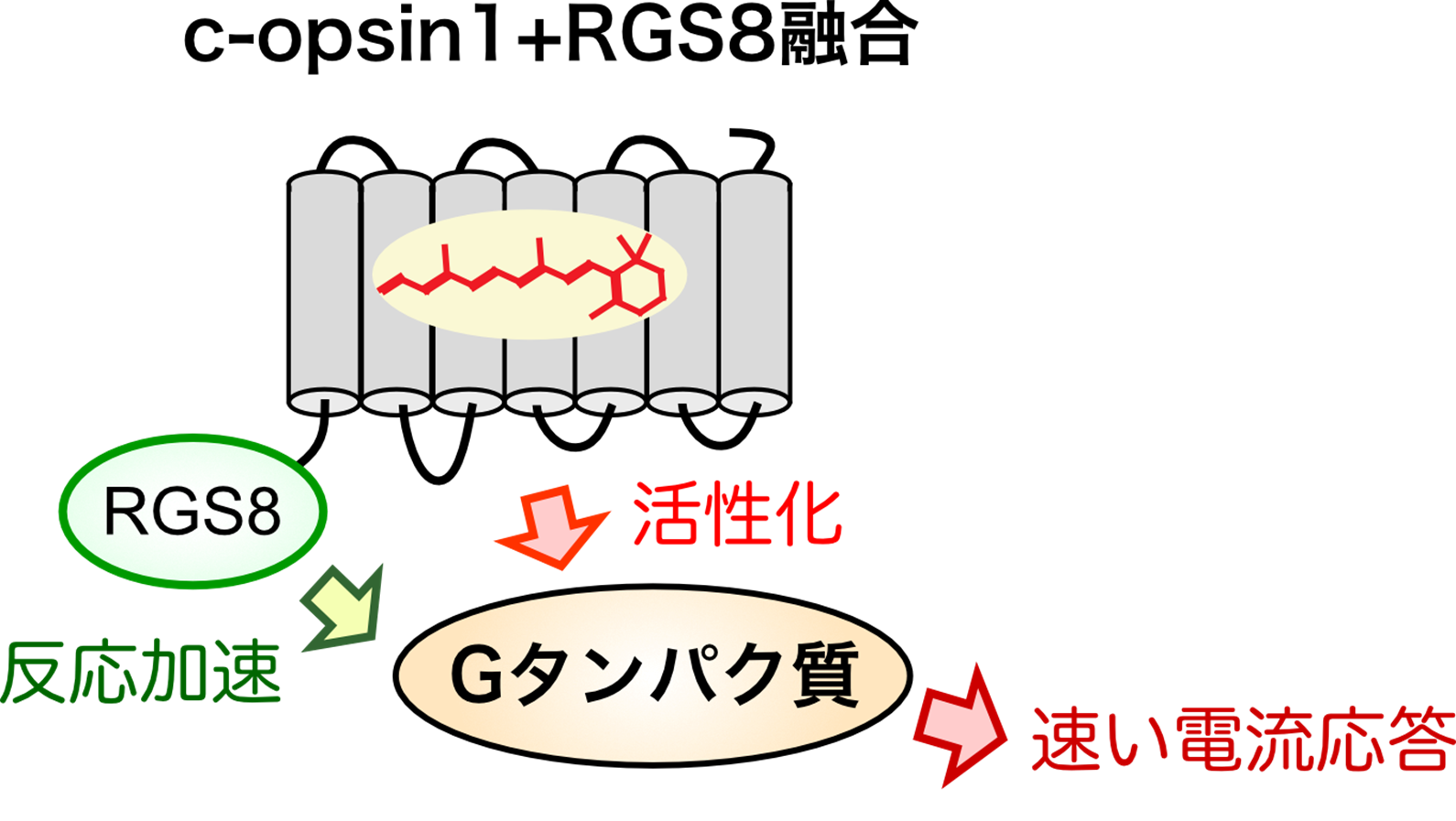 (図3)
(図3)
ゴカイc-opsin1にRGS8を人工的に融合させることで、シグナル伝達を加速し、速い電気応答をより選択的に駆動できるように「強化」できた(図2参照)。
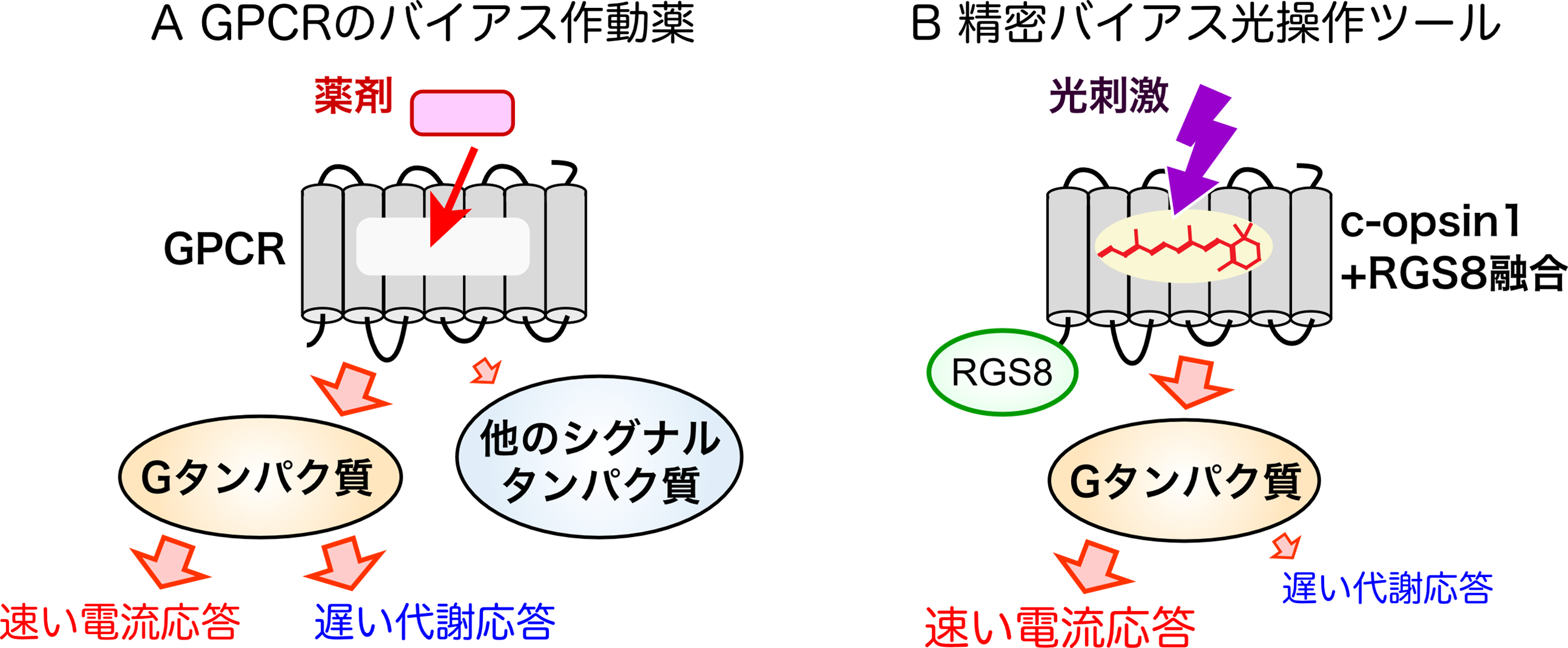 (図4)
(図4)
A:GPCRのバイアス作動薬は、Gタンパク質などのGPCR下流のシグナル伝達経路のうち、特定の経路を選択的に活性化する作用がある。
B:c-opsin1+RGS8融合タンパク質は、紫外光刺激に応じて、Gタンパク質の下流の経路のうち速い電気応答を選択的に駆動する「精密バイアス光操作ツール」として機能する。
用語解説
*1 光遺伝学: 生体組織や細胞に、人為的に光受容タンパク質を導入し、光刺激によって生理応答を操作することで生理機能の理解を深める研究手法。
*2 Gタンパク質共役受容体(G protein-coupled receptor, GPCR): 主に細胞膜に存在し、細胞外のシグナルを受容して細胞内の三量体Gタンパク質や他のシグナルタンパク質を活性化することで、細胞内にシグナルを伝達する受容体タンパク質。ヒトが持つ2万個程度の遺伝子のうち、800個程度がGPCRをコードしており、現在使われている臨床薬の3割程度がGPCRを標的にしている。動物が持つオプシンというタンパク質は光を受容するGPCRであり、視覚や体内時計の光調節などを担っている。
*3 ゴカイ: 環形動物門に属する無脊椎動物の一種。釣りのエサなどに用いられる。
謝辞
本研究は、日本学術振興会科学研究費補助金基盤研究(B) 21H02445(代表:塚本寿夫)および20H03424(代表:久保義弘)、JSTさきがけ JPMJPR1787(代表:塚本寿夫)、生理学研究所計画共同利用研究(代表:塚本寿夫、所内対応者:久保義弘)などの支援を受けて行われました。これらの支援に深く感謝いたします。
論文情報
・タイトル
“A self-inactivating invertebrate opsin optically drives biased signaling toward Gβγ-dependent ion channel modulation”
DOI:10.1073/pnas.2301269120
・著者
Hisao Tsukamoto and Yoshihiro Kubo
・掲載誌
Proceedings of the National Academy of Sciences of the United States of America, PNAS
問い合わせ先
< 研究について >
■神戸大学理学研究科生物学専攻・神戸大学次世代光散乱イメージング科学研究センター
准教授 塚本 寿夫
■自然科学研究機構生理学研究所神経機能素子研究部門
教授 久保 義弘
< 報道担当 >
■神戸大学総務部広報課
■自然科学研究機構生理学研究所 研究力強化戦略室
リリース元


神戸大学
自然科学研究機構 生理学研究所
552





