概要
山梨大学 大学院総合研究部 医学域 基礎医学系 薬理学講座及び山梨GLIAセンター 小泉修一教授及び齋藤光象助教の研究チームは、これまで知られていなかった、稀少な難治性神経変性疾患である「アレキサンダー病」の病態保護作用に関与する細胞を発見しました。本研究には自然科学研究機構 生理学研究所の鍋倉淳一所長及び堀内浩助教らが協力しました。
アレキサンダー病
[1]は、本邦の患者数約50名の超稀少な難治性神経変性疾患であり、根本的な治療法は確立されていません。アレキサンダー病はグリア細胞
[2]の一種である「アストロサイト」
[3]特異的遺伝子
GFAP遺伝子
[4]の変異が原因で発症します。したがってアレキサンダー病は一次性アストロサイト病とも呼ばれています。しかしながら、同一の
GFAP変異を有していてもアレキサンダー病の発症年齢、重症度、臨床経過には幅広い多様性があることが知られていました。また、ほぼ無症候や軽症での経過中に急な病状進行を見る症例もあり
GFAP変異以外もしくはアストロサイト以外の疾患修飾因子の存在が疑われていました。
脳は神経細胞とグリア細胞から構成されていますが、グリア細胞には前述したアストロサイト以外に、ミクログリア
[5]と呼ばれるグリア細胞が存在します。ミクログリアは、種々の脳疾患等による脳内環境の変化に敏感で、これらを検知すると素早くその性質を変えることにより疾患を抑制したり、逆に悪化させたりすることが知られています。研究チームは、このミクログリアに着目し、アレキサンダー病の病態との関連性を検討しました。研究には、実際のアレキサンダー病患者さんと同様に、アストロサイト遺伝子
GFAPに変異を導入したマウスを用いて(アレキサンダー病モデルマウス)、特殊顕微鏡(2光子顕微鏡)による解析、1細胞RNAシーケンス解析
[6]などの最先端技術による解析を行いました。アレキサンダー病マウス脳では、
GFAP変異によりアストロサイトが異常な性質を呈していましたが、ミクログリアもまた形態や性質が大きく変化していました。ミクログリアは、このアストロサイトの異常を「P2Y12 受容体」
[7]と呼ばれる蛋白質で感知して、自身の形態や性質を変化させていることが解りました。このP2Y12受容体を薬理学的、分子生物学的手法により抑制すると、ミクログリアはアストロサイトの異常を感知できなくなり、アレキサンダー病モデルマウスの病状が悪化することが解りました。すなわち、ミクログリアはアストロサイト病態を監視しながらアレキサンダー病の病態進行抑制に関与することが示唆されました。
アレキサンダー病は一次性アストロサイト病であるため、これまでの研究はアストロサイトに注目した研究が殆どでした。しかし今回、もう一つのグリア細胞であるミクログリアが本疾患の重要な修飾細胞であり、病態に大きく影響していることが明らかとなりました。これらは、ミクログリアへの介入が、将来に全く新しいアレキサンダー病の治療戦略になる可能性を示唆するものです。本研究成果は英国オックスフォード大学出版局が刊行する国際医学誌「BRAIN」に掲載されます。
論文情報
論文タイトル
Microglia sense astrocyte dysfunction and prevent disease progression in an Alexander disease model
著者
Kozo Saito, Eiji Shigetomi, Youich Shinozaki, Kenji Kobayashi, Bijay Parajuli, Yuto Kubota, Kent Sakai, Miho Miyakawa, Hiroshi Horiuchi, Junichi Nabekura and Schuichi Koizumi*
*責任著者
掲載誌
BRAIN 誌
[2023年11月13日午前9時(日本時間)/2023年11月13日午前0時(英国標準時)に掲載されました]
DOI: 10.1093/brain/awad358
背景
アレキサンダー病は、非常に稀で難治性の神経変性疾患で、ほぼすべての患者さんにおいて、アストロサイト特異的遺伝子である
GFAP遺伝子に変異が認められます。この病気は新生児から高齢者まで幅広い年齢で発症しますが、新生児や乳児期に発症する患者さんはけいれん、頭囲拡大、精神運動発達の遅れが出現し、幼少期に亡くなってしまうこともあり、生命予後は不良です。成人期に発症する患者さんは新生児や乳児期に発症する患者さんと比べると生命予後は良好ですが、四肢の運動障害、嚥下障害、排尿困難など日常生活に大きな支障をきたし機能予後は不良なことが多いです。
アストロサイトは、グリア細胞のひとつであり、中枢神経系の栄養代謝、シナプス可塑性、細胞間の情報伝達機能など多様な役割を果たしています。これまでの基礎医学研究や臨床研究から、アレキサンダー病の発症にはアストロサイトの機能異常が関係することが推定されています。また、病気の発症年齢、重症度、臨床経過には大きな多様性があることが知られています。同一の
GFAP変異であっても、ほぼ無症状に近い軽症例の報告もあることから、
GFAP遺伝子、あるいはアストロサイト以外の要因が病状に影響する可能性が指摘されていました。しかし、その他の要因についてはよく分かっていませんでした。
そこで私たちはもうひとつのグリア細胞のミクログリアに着目しました。ミクログリアは中枢神経の免疫細胞として病原体・異物除去の役割を担っています。しかし、免疫細胞としての役割以外に、脳内環境変化をモニターし、神経細胞の活動や神経ネットワークの構築を制御するなど、脳の中核機能を調節維持する細胞として近年非常に注目されています。さらにミクログリアは様々な脳疾患と関係することが分かってきました。それぞれの疾患状況においてミクログリアは、病的状態を抑制したり、逆に悪化させたり、あるいは直接病気の原因となったりすることもあります。これまでアレキサンダー病の病態におけるミクログリアの役割については詳しく調べられてはいませんでした。私たちはアレキサンダー病のモデル動物実験において、ミクログリア機能解析及び1細胞RNAシーケンス解析による網羅的遺伝子発現解析による検証を進めた結果、ミクログリアが本疾患病態の進行を抑制することを明らかにしました。ミクログリアが病態修飾因子として、実際の病状に大きく影響を及ぼす可能性が示唆されました。今回の私たちの発見により、アレキサンダー病のさらなる病態解明や新規治療法開発が進展することが期待されます。
研究成果
1.アレキサンダー病モデルマウスのミクログリアの特徴的な形態・機能変化
アレキサンダー病の疾患モデルマウスとして、乳児期に発症する患者さんで比較的多いR239H変異(239番目のアルギニンがヒスチジンに置き換わった変異)を有するヒト
GFAP遺伝子のトランスジェニックマウスを用いました。アレキサンダー病モデルマウスの脳では、アストロサイトの形態が特徴的に変化していました。このような異常アストロサイトが密集している部位には、ミクログリアも集積し、これらのミクログリアは過剰に突起が増加した形態変化を示しました(図1)。このようなミクログリアは、異常アストロサイトのシグナルを感知して強く応答し、活性化状態にあると考えられました。この活性化したミクログリアの機能変化を調べるため、2光子励起レーザー顕微鏡によるCa
2+イメージングを行いました(図2A)。ミクログリアの細胞内Ca
2+が変化すると蛍光を発するような遺伝子改変動物と交配させることによってミクログリアCa
2+イメージング用のアレキサンダー病モデルを作成し、観察したところ、ミクログリアが活発なCa
2+シグナルを発生させていることがわかりました(図2B)。さらに行った実験により、活性化Ca
2+シグナルは、ミクログリアに特異的に発現するP2Y12受容体を介して生じていることが明らかになりました。
2.網羅的遺伝子発現解析(1細胞RNAシーケンス解析)によるミクログリア活性化機序の解明
この活性化Ca
2+シグナルの分子メカニズムを明らかにするため、1細胞RNAシーケンス解析により、特定の脳部位(海馬)における全細胞の網羅的遺伝子発現解析を行いました。アレキサンダー病モデルでは、ミクログリアのP2Y12受容体の発現量自体は増加していませんでした。したがってCa
2+シグナル増によるミクログリアの活性化には、この受容体のリガンド(刺激物質)であるATP及びADPの細胞外濃度上昇が関係している可能性が考えられました。そこでATP放出やATPの分解、取り込みに関連する遺伝子の発現状態を調べたところ、アストロサイト特異的なATP分解酵素の遺伝子Entpd2(タンパク質名:「NTPDase2」[8])の発現が低下していることが解りました(図3)。つまり、アレキサンダー病脳では、アストロサイトのNTPDase2発現が低下していることにより、ATP及びADPが分解されずに高濃度で存在するようになります。ミクログリアは、これらを病態シグナルとしてP2Y12受容体によって感知し、Ca
2+シグナル上昇、形態変化等の活性化状態を示すことが示唆されました。
3.ミクログリアによる病態抑制効果
アストロサイト異常によって細胞外ATP濃度が増加し、これをミクログリアが感知して活性化することが解りました。それではこの活性化したミクログリアはアレキサンダー病の病態に対してどのような役割を果たしているのでしょうか?この疑問を明らかにするため、アレキサンダー病モデルマウスにP2Y12受容体阻害薬であるクロピドグレルを投与し、疾患病態への影響を調べました。クロピドグレルは、海馬においてアレキサンダー病の病態マーカーであるローゼンタル線維を増加させ(図4A)、さらに神経細胞障害を起こすこと、つまりアレキサンダー病の病態を増悪させることが明らかになりました(図4B)。クロピドグレルを野生型マウス(正常なマウス)に投与しても、このような変化は認められませんでした。また分子生物学的な手法(siRNAを使ったRNA干渉法)を用いて、P2Y12受容体遺伝子の発現を低下させた場合にも、上記クロピドグレルと同様、疾患の増悪作用が認められました。つまり、ミクログリアはP2Y12受容体によりアストロサイトの異常を感知して活性化した後、アレキサンダー病の病態進行の抑制に関与することが強く示唆されました(図5)。
今後の展開
本研究の結果は、世界で初めてミクログリアが一次性アストロサイト疾患「アレキサンダー病」の進行抑制に関与することを実験的に示したものです。今後にさらに本疾患の病態解明が進むことや今回の知見が臨床的研究にも活用されることなどにより、本研究の意義がさらに高まるものと想定されます。
これまで、アレキンサンダー病において根本的な治療法は確立されていませんでしたが、新しい治療標的としてミクログリアを見出すことができました。今後、ミクログリアの機能を調節制御する、という新たな戦略による治療薬の開発が期待されます。
本研究は、科研費 学術変革領域研究(A)、基盤研究(A)、挑戦的萌芽研究、若手研究、学術変革領域研究「先進ゲノム支援」(PAGS)及びAMED-CRESTによる支援を受けて行われました。
図および説明
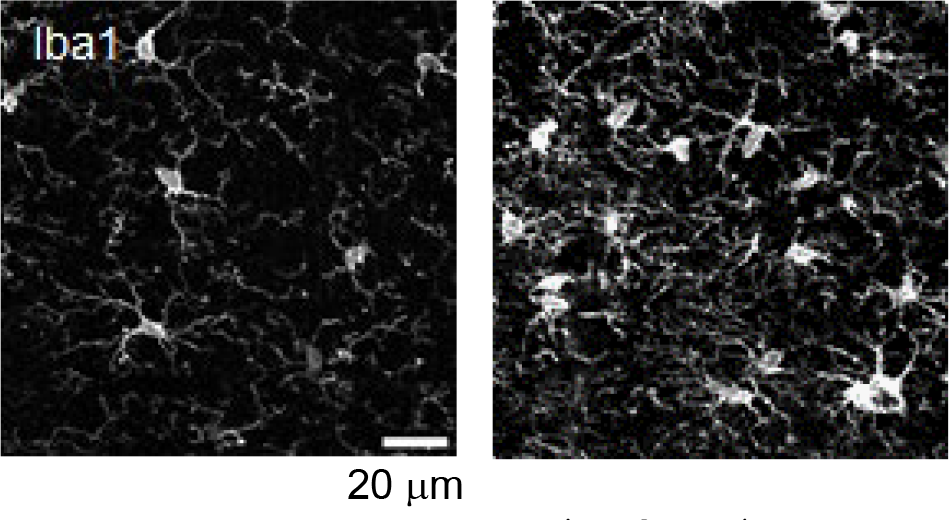 図1.アレキサンダー病モデルマウスにおけるミクログリアの形態変化
図1.アレキサンダー病モデルマウスにおけるミクログリアの形態変化
ミクログリアのマーカーIba1による免疫染色画像。野生型マウス(左)に比べて同病モデルマウス(右)では、ミクログリアの細胞数増加及び細胞突起増加を主体とした形態変化が観察された。
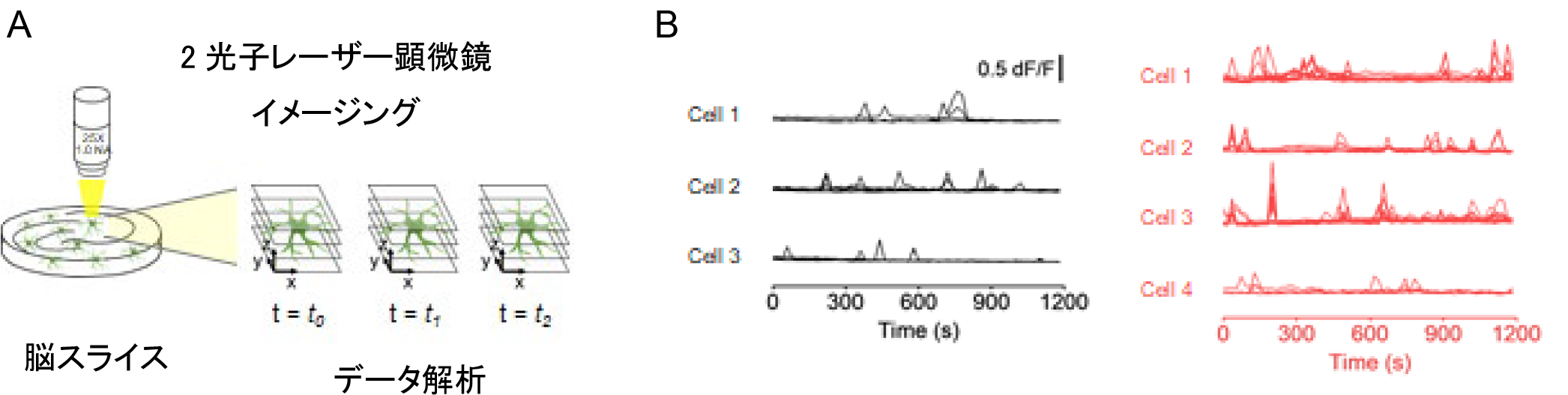 図2.アレキサンダー病モデルマウスにおけるミクログリアCa2+シグナルの活性化
図2.アレキサンダー病モデルマウスにおけるミクログリアCa2+シグナルの活性化
(A) 2光子励起レーザー顕微鏡を用いた脳スライスのミクログリアCa
2+イメージング法の概略図。(B)コントロールマウスのイメージングデータ(左図)とアレキサンダー病モデルマウスのデータ(右図)。Ca
2+シグナルの頻度、振幅ともにモデルマウスにおいて増加し、ミクログリアの活性化した状態が観察された。
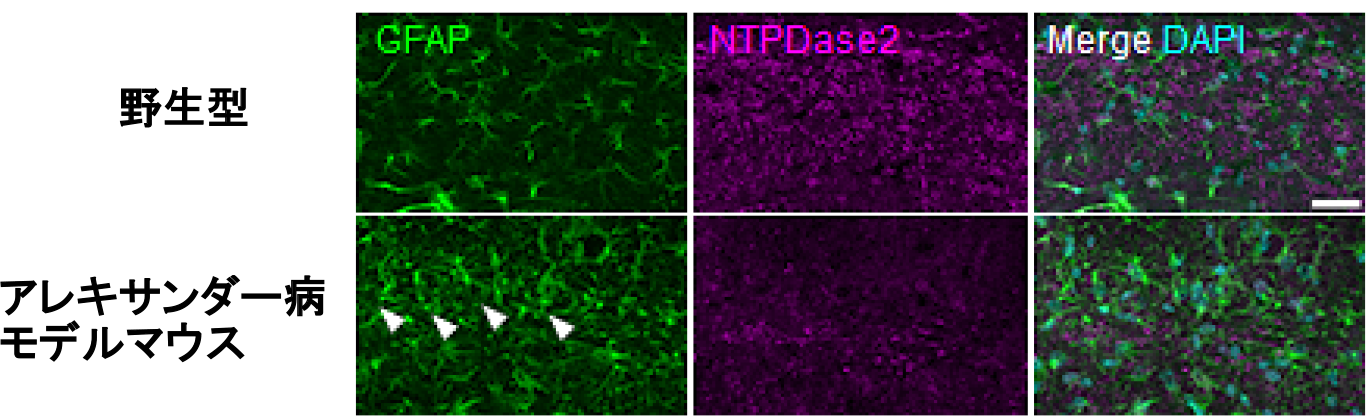
図3.アレキサンダー病モデルにおけるアストロサイト特異的なATP分解酵素(NTPDase2)の発現低下
GFAP・NTPDase2の共染色画像。アレキサンダー病モデルマウスにおいてNTPDase2発現低下が認められた。1細胞RNAシーケンス解析と一致した結果を示した。
GFAP異常凝集陽性アストロサイト(白矢頭)でとくにNTPDase2発現が低下している。
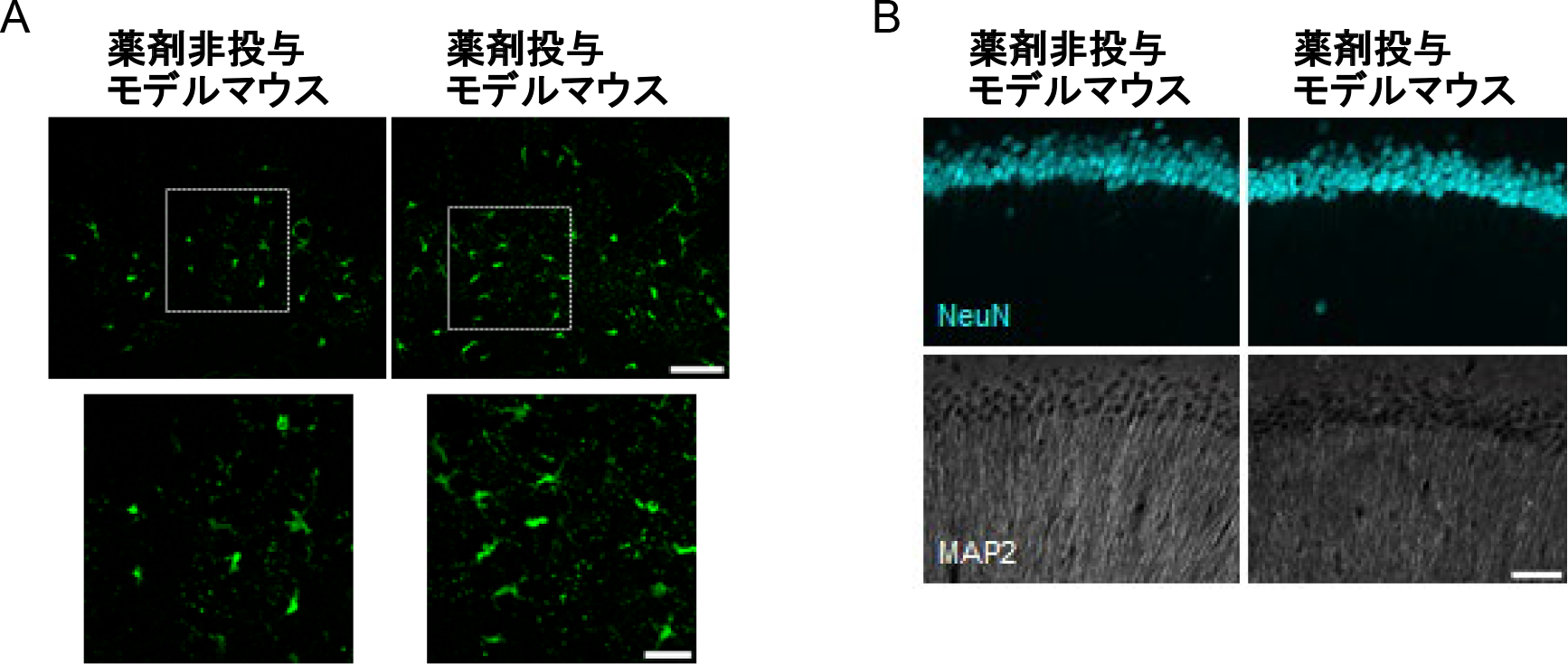 図4.P2Y12受容体拮抗薬 クロピドグレル投与によるアレキサンダー病モデルのアストロサイト病態増悪と神経細胞障害
図4.P2Y12受容体拮抗薬 クロピドグレル投与によるアレキサンダー病モデルのアストロサイト病態増悪と神経細胞障害
(A)FluoroJade染色。アレキサンダー病の病態マーカーのローゼンタル線維を検出することができる。クロピドグレルを投与したモデルマウス(右)では非投与のモデルマウス(左)と比較して、FluoroJade陽性細胞数が増加した。アストロサイト病態悪化が示唆された。(B)神経マーカーのNeuN・MAP2の共染色画像。クロピドグレルを投与したモデルマウス(右)では、非投与マウス(左)に比べてMAP2シグナル低下が顕著であり、神経障害が発生していると考えられる。
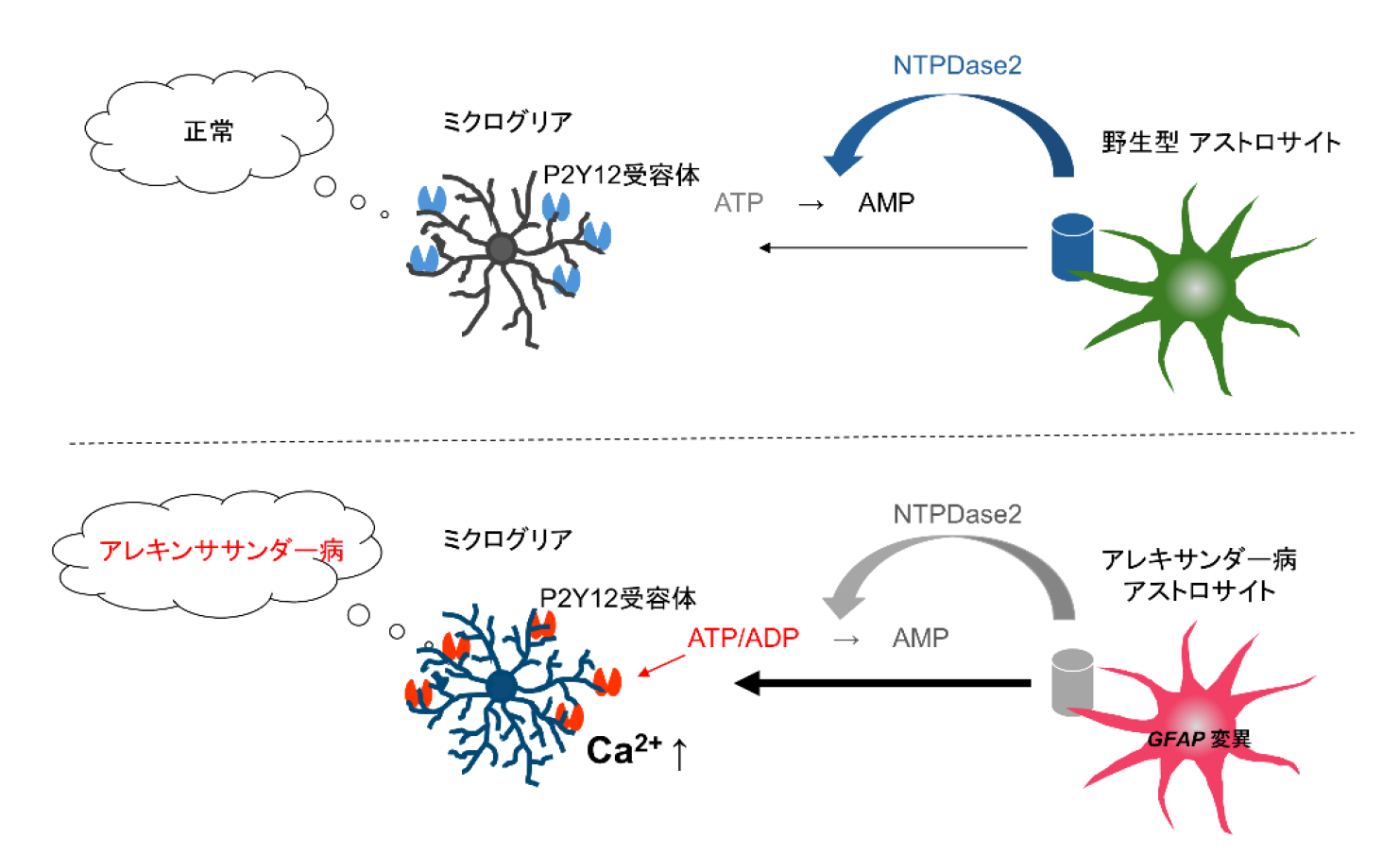 図5.アレキサンダー病モデルのミクログリアによる病態抑制の概要
図5.アレキサンダー病モデルのミクログリアによる病態抑制の概要
アストロサイトの病態によってNTPDase2発現低下が起こり、ATP分解遅延が発生する。
これによって生じた細胞外ATP濃度上昇がミクログリアのP2Y12受容体によって感知され、同受容体を介したCa
2+シグナル活性化が生じる。このようなアストロサイト病態に由来するATP濃度変化をミクログリアは病態シグナルとして認識する。この一連のシグナル経路はミクログリア機能変化を誘導し、アストロサイト病態への抑制的作用をもたらす。
用語説明
[1] アレキサンダー病
アレキサンダー病は、1949年にAlexander により初めて報告された稀少難病。本疾患は乳児期に発症し、けいれん、大頭症、精神運動発達遅滞を中核症状とした、生命予後不良の疾患であると考えられていた。これまでは生前の診断確定は難しく、死後脳病理組織検査が主な診断法であった。しかし、2001年にBrennerらにより、本疾患の原因遺伝子としてGFAPが同定されて以来、臨床所見、画像検査、遺伝子検査による診断が一般的となった。それ以後、成人発症で緩徐な進行経過の症例も報告されるようになった。
[2] グリア細胞
グリア細胞は、中枢神経系に常在する非神経細胞であり、主にアストロサイト、オリゴデンドロサイト、ミクログリアから構成される。神経細胞のように電気的な興奮性は示さない。神経細胞を物理的に支持するだけでなく、脳の発達、神経活動の機能維持・調節、脳内環境の恒常性に関与している。脳の健康を保つために神経細胞とグリア細胞は相互に協調しながら働く。また何らかの病気の状態が発生すると、グリア細胞はそれに応答して状態変容が起きる。また、アレキサンダー病のように、グリア細胞自体の異常が病気の原因となる場合もある。
[3] アストロサイト
アストロサイトはグリア細胞の一種。神経細胞周囲に豊富に存在し、神経細胞の物理的支持、栄養代謝供給、神経機能調節など、脳の生理機能維持を担う。一方、脳外傷、脳卒中、てんかん、中枢神経感染症、神経変性疾患などの様々な病態時において活性化状態へ移行し、その形態・性質を変化させる。
[4] GFAP遺伝子
GFAP遺伝子はグリア線維性酸性タンパク(GFAP)をコードする。GFAPはアストロサイトに選択的に発現する蛋白質の一つであり、代表的なアストロサイトマーカーの一つ。中間径フィラメントと呼ばれる細胞骨格を形成する線維の構成成分。何らかの病態ストレスによりアストロサイトにおいてGFAP発現が亢進し、反応性アストロサイト、さらにはアストログリオーシスと呼ばれる状態に遷移する。
[5] ミクログリア
中枢神経系に常在するグリア細胞の一種であり、中枢神経系の自然免疫細胞。環境変化を検知し、微細な突起を含めて細胞形態を変化させる。免疫細胞としての病原体・異物排除の役割だけでなく、中枢神経系の恒常性維持、病態時の一次的応答を担っている。神経活動の調整・制御維持にも関与し、また様々な各病態と関連しながらその形態及び機能を変化させる。
[6] 1細胞RNAシーケンス解析 single-cell RNA sequencing analysis
1細胞RNAシークエンス解析は、組織内の細胞ひとつずつに分離して、それら1個の細胞ごとに遺伝子発現量を網羅的に調べる方法。数千から数万細胞の遺伝子発現データを数理学的・情報学的にデータ解析する。細胞の分類、同一細胞種の多様性の理解、疾患病態の解析における有用なツールとして確立されており、医学・生物学研究に広く活用されている。
[7] P2Y12受容体
P2Y12受容体はミクログリアに特異的に発現する受容体。ADPが最も親和性の高い内因性リガンドとして知られている。ATPもリガンドとしての結合能力がある。これらATP、ADPによるP2Y12受容体への結合刺激によって、ミクログリア突起の運動伸展が促進される。P2Y12受容体は、このほかにも神経機能制御、脳血管調節など多様な機能にも関与することが明らかになっている。
[8] NTPDase2
ATP分解酵素、エクトヌクレオチダーゼのひとつであり、アストロサイトに特異的なタンパク質。別名CD39L1とも呼ばれる。細胞外に遊離したATPをADPに変換する作用がある。一方、NTPDase1は、ATPをAMPに変換する作用があり、ミクログリアに多く含まれる。ATPは細胞のエネルギー物質としての役割があるが、細胞外の情報伝達物質としても作用する。また、これらエクトヌクレオチダーゼの作用によりATPから変換されたADP、アデノシンもまた情報伝達分子として作用し、それぞれ特異的な受容体(P2受容体、P1受容体)に結合作用する。
研究チーム
山梨大学 大学院総合研究部 医学域 基礎医学系 薬理学講座/GLIAセンター
教授 小泉 修一 (責任著者)
特任助教 齋藤 光象 (筆頭著者)
准教授 繁冨 英治
准教授 篠崎 陽一 (現 東京都医学総合研究所 副参事研究員)
学部生 小林 憲司
特任助教 パラジュリ ビージェイ
特任助教 坂井 謙斗
博士研究員 宮川 美保
大学院生 久保田 友人
生理学研究所
所長 鍋倉 淳一
特任助教 堀内 浩 (生体恒常性発達研究部門 現 同研究所 多細胞回路動態研究部門)
本件に関する問い合わせ先
<研究について>
国立大学法人山梨大学 大学院総合研究部 医学域 基礎医学系薬理学講座/GLIAセンター
教授 小泉 修一(コイズミ シュウイチ)
大学共同利用機関法人自然科学研究機構 生理学研究所
所長 鍋倉 淳一(ナベクラ ジュンイチ)
<広報に関すること>
国立大学法人山梨大学 総務企画部総務課広報企画室
大学共同利用機関法人自然科学研究機構 生理学研究所 研究力強化戦略室
リリース元


国立大学法人 山梨大学
自然科学研究機構 生理学研究所
567






