自然科学研究機構 生命創成探究センター (ExCELLS) / 生理学研究所の榎木亮介准教授、根本知己教授らの研究グループは、名古屋大学トランスフォーマティブ生命分子研究所(WPI-ITbM)の金尚宏特任講師、北海道大学低温科学研究所の山口良文教授らとの共同研究で、脳にある約24時間リズム(概日リズム)の司令塔である神経細胞の集団は、低温にさらされるとリズムを刻むのを停止し、再び温めると時刻がリセットしてリズムを再開することを見いだしました。またこのリズムの停止と再開のしくみには、細胞内にあるカルシウムイオンが重要であることも分かりました。
私たちの身体を構成する細胞や臓器は約24時間のリズム持っており、心と体の健康に重要です。その24時間のリズムを制御しているのは、概日リズム中枢と呼ばれる脳の深部の視交叉上核(しこうさじょうかく)という部分の神経細胞の集団の活動であることが知られています。今回、その概日リズム中枢が時を刻む様子を、温度を変えながら長期間に渡ってリアルタイムに観察することに成功しました。この研究結果は、哺乳類の冬眠に見られるような極端な低体温の状態ではリズムは停止すること、冬眠が終了すると時刻がリセットされてリズムが再開することを示唆しています。この発見は、長年の謎である冬眠のメカニズムの理解に貢献するものと期待されます。
本研究成果は、国際科学雑誌 「iScience」 (2023年11月3日付) に掲載されました。
発表のポイント
-
哺乳類の概日リズム中枢の神経細胞は、15℃付近の低温ではリズムが停止し、35℃付近の温度に戻すと時刻がリセットして再開することを発見。
-
概日リズムの停止とリセットの仕組みには、細胞内のカルシウムイオンが重要であることが明らかに。
-
哺乳類の冬眠のような極端な低体温では概日リズムは停止し、冬眠が終了した後には新たな時刻から再開することを示唆。
-
研究結果は、長年謎であった哺乳類の冬眠時の概日リズムのメカニズムに関する基礎科学的な価値を持つものであり、冬眠という不思議な生命現象の全容解明への重要な一歩であると期待。
 研究のイメージイラスト
研究のイメージイラスト
ネズミたちがアリスの "狂ったお茶会 "でテーブルを囲んで座っており、ネズミたちはそれぞれ時計を持っている。テーブル奥側の寒い冬の季節にいるネズミたちは、冷たいお茶を出されているが眠っており、時計は止まっている。一方、テーブル手前の暖かい春の季節になったネズミたちは、目を覚まして暖かいお茶を飲んでおり、同じ時刻で時計が動いている。イラストは株式会社スペースタイム・中村景子、SOFA GRAPHIC DESIGN・安達浩之の協同制作。
背景
地球上のほぼ全ての生物は、約24時間の時を刻む「概日リズム」
*1の機能をもっており、昼夜の明暗サイクルや温度変化などの環境変化を予測し、特定の時刻に生理機能が最大になるようにするなど、自身の生存を有利にしています。私たち哺乳類では、概日リズムは全身ほぼすべての細胞で観察され、細胞レベルでの概日リズムの分子メカニズムは「時計遺伝子」
*2の転写と翻訳によるフィードバックループにあると考えられています。哺乳類の概日リズムの中枢は、脳の深部に位置する「視交叉上核(しこうさじょうかく)」
*3と呼ばれる部位に局在しており、睡眠覚醒サイクルや体温リズム、ホルモン分泌など、全身のあらゆる生理機能の概日リズムを調節しています(図1)。概日リズムは、自律振動性(自ら時を刻む)、同調性(周囲の環境に合わせる)、温度補償性(温度が変わってもリズム周期が変わらない)の3つの要素を持つことが不可欠であると考えられています。
哺乳類は体温を恒常的に保つ「恒温動物」であり、体温を37℃前後の非常に狭い範囲に維持し、わずか数度の体温変化でも生理機能が影響を受け、低体温が長く続くと不可逆的な細胞損傷を受けます。しかし冬季のように食物が不足する過酷な環境では、一部の哺乳類は「冬眠」という状態に入り、自身の熱産生や代謝を抑制した「低体温-低代謝状態」になり、体温が環境温度の付近まで低下します。冬眠中の体温が極端に低下した動物において、温度補償性の機能をもつ概日リズム中枢のリズムが継続しているのかという素朴な科学的な疑問に関しては、過去数十年にわたり多くの研究が行われてきましたが、いまだ決着がついていませんでした。これまでの研究では、生きた細胞や組織から長期的に概日リズムを計測することが技術的に難しかったこと、また概日リズムの存在を判断するために「時計遺伝子の発現を計測すれば十分なのか?」という根本的な問題がありました。時計遺伝子は概日リズムの主要な構成要素であることは間違いないものの、時計遺伝子を欠損した細胞や組織でもリズムが観察されることも報告されており、時計遺伝子以外にも時を刻むメカニズムがある可能性も指摘されてきました。
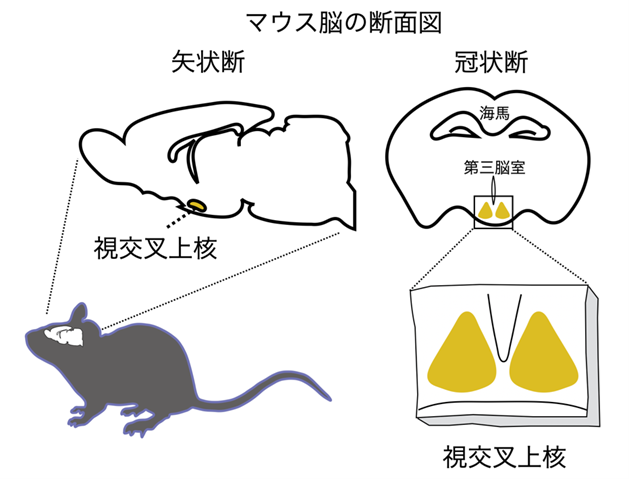 図1. 概日リズム中枢の視交叉上核
図1. 概日リズム中枢の視交叉上核
マウス脳の断面図(矢状断、冠状断)と視交叉上核の位置を示している。
視交叉上核は脳深部の視床下部領域にある一対の神経核であり、約2万個の神経細胞から構成されている。
本研究の内容
榎木らの研究グループはこれまで、生きたまま細胞の機能を観察できる光イメージング技術を駆使して、数日~週レベルの長い期間観察することで、概日リズム中枢である視交叉上核の単一神経細胞~神経回路でのリズム発振メカニズムを研究してきました。本研究では、さまざまな温度で概日リズムの光イメージング計測を行うため、タイムラプス顕微鏡システムを温度制御チャンバー内に設置し、マウスおよびハムスターの視交叉上核の時計遺伝子の転写リズムと細胞内カルシウムの概日リズムを同時かつ長期間計測し、視交叉上核の低温特性を詳しく解析しました(図2および図3)。
その結果、視交叉上核の時計遺伝子の転写と細胞内カルシウムの概日リズムは、22℃~35℃の温度帯域ではリズムを刻み続けるものの(図4A)、15℃程度の低温にさらされると停止してリズムが見られなくなることを見いだしました(図4B)。また予想しなかったことに、15℃の低温から35℃付近の温度に戻すと、両方の概日リズムの時刻がリセットされ再度時を刻み始めることが分かりました(図4B)。さらに詳しくデータを解析した結果、15℃では細胞内カルシウム濃度が上昇した状態でリズムが停止していること(図5)、また復温後には概日カルシウムリズムが速やかに安定なリズムを回復するのに対し、時計遺伝子の転写リズムは数日かけて次第に概日カルシウムリズムに追随するようにリズムが回復することを見いだしました(図6)。この結果は、細胞内カルシウムリズムが時計遺伝子の転写リズムを制御していることを示しており、時計遺伝子の転写のみならず細胞内カルシウムも重要であることを示しています。
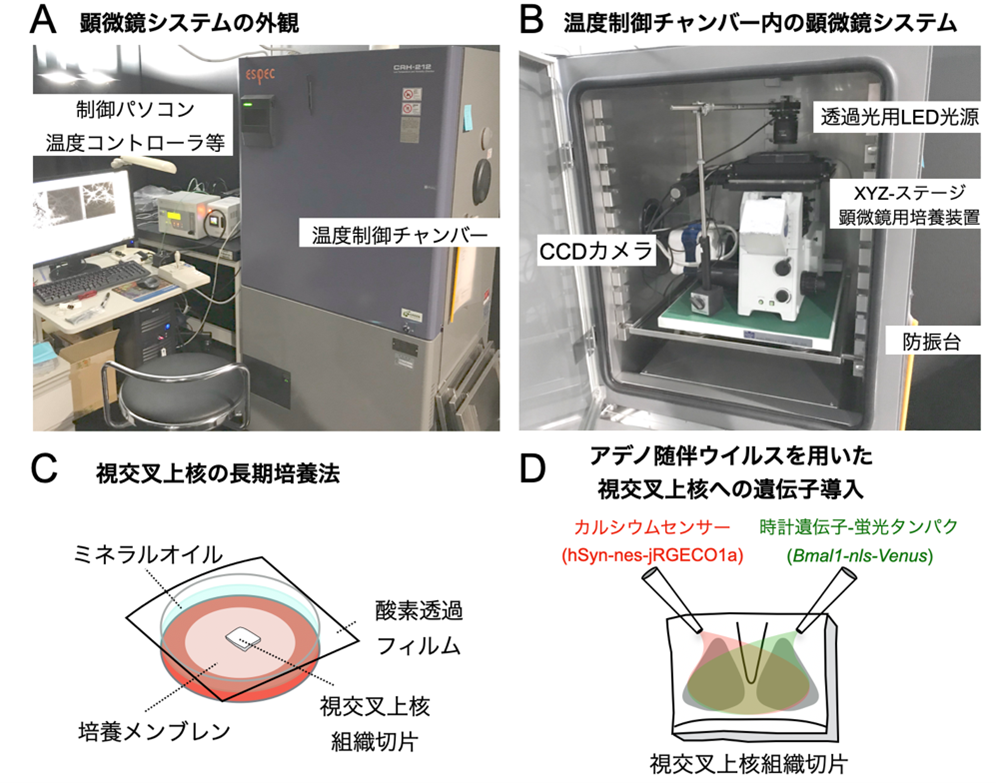 図2. 研究方法の概要
図2. 研究方法の概要
A. 温度制御チャンバー内に構築した顕微鏡システム。チャンバーの外から顕微鏡を自在に操作できる。
B. チャンバー内の顕微鏡システム。CCDカメラ、LED光源、XYZステージ、培養装置、防振台などから構成される。
C. 視交叉上核の培養法。 培養メンブレン上に組織切片を静置し、酸素透過フィルムでディッシュを密閉する。
培養液が温度変化により蒸発しないようミネラルオイルを培養液上に添加している。
D. 視交叉上核の組織切片への遺伝子導入法。アデノ随伴ウイルス用い、カルシウムセンサー、および、時計遺伝子
プロモーター下に蛍光タンパク質を発現する遺伝子配列を、神経細胞に発現させる。
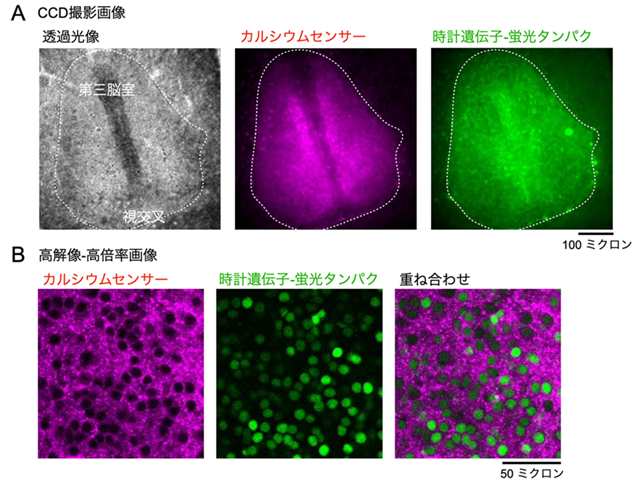 図3.視交叉上核に発現するカルシウムセンサーと蛍光タンパク質の空間分布
図3.視交叉上核に発現するカルシウムセンサーと蛍光タンパク質の空間分布
A. CCD撮影画像。組織全体にカルシウムセンサーおよび蛍光タンパクの発現を確認。点線枠線は視交叉上核の位置を示す。
B. 高解像-高倍率画像。カルシウムセンサーおよび蛍光タンパクは細胞内の細胞質-核内に発現している。
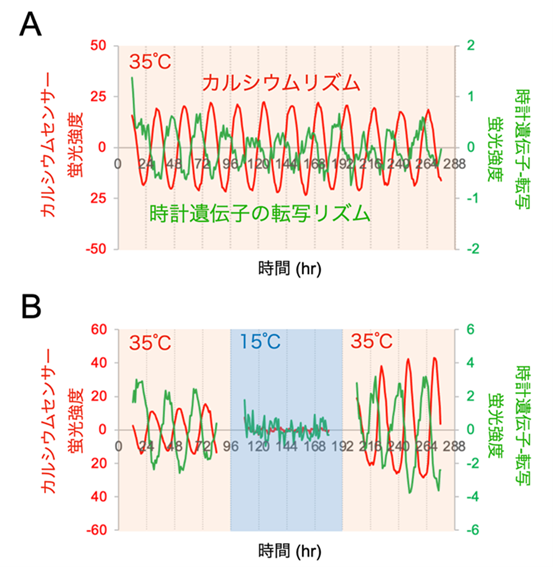 図4. 時計遺伝子の転写(緑)と細胞内カルシウムイオン濃度(赤)の概日リズム
図4. 時計遺伝子の転写(緑)と細胞内カルシウムイオン濃度(赤)の概日リズム
A. 35℃で12日間測定した概日リズムのデータ。ほぼ逆位相(約12時間のタイミングのずれ)で両者のリズムが安定して継続している。
B. 35℃で4日間計測後、15℃の低温に暴露するとリズムが停止した。再び35℃に加温するとリズムが再開する。
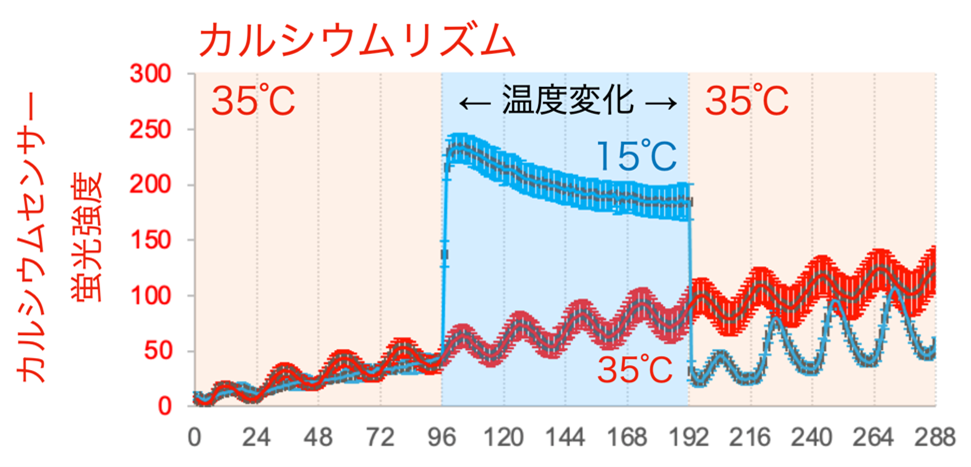 図5. 低温に暴露した概日カルシウムリズム
図5. 低温に暴露した概日カルシウムリズム
35℃で概日カルシウムリズムを計測した後、15℃の低温を4日間暴露し、その後35℃に再び加温した。概日カルシウムリズムは低温に晒されると、カルシウム濃度が上昇してリズムが停止した(青レース)。一方で、通して35℃で計測した際はリズムが継続した(赤レース)。
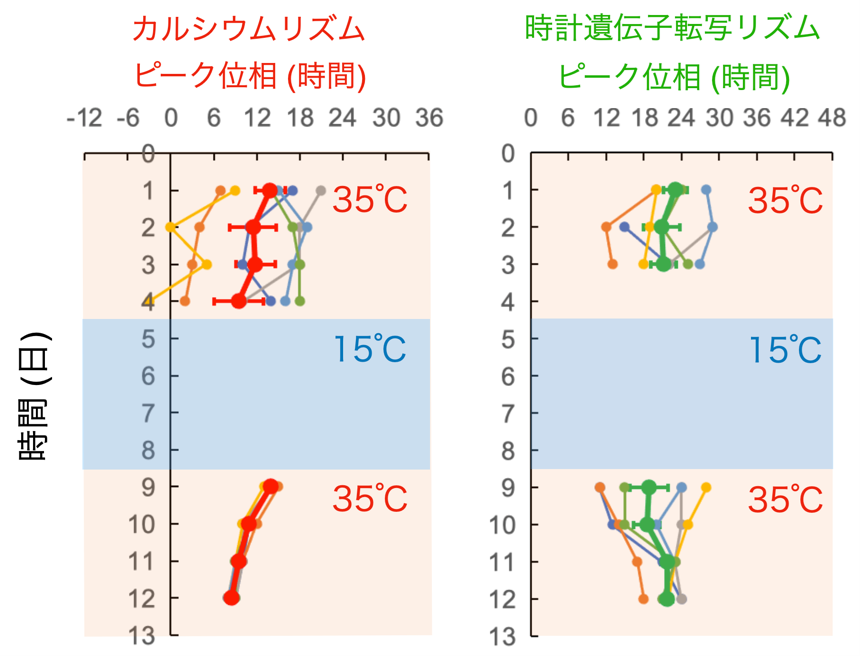 図6. 概日カルシウムリズムと時計遺伝子の転写リズムのピーク位相の経時変化
図6. 概日カルシウムリズムと時計遺伝子の転写リズムのピーク位相の経時変化
縦軸は日数、横軸はリズムの日内でのピーク位相(タイミング)を示している。低温暴露前は、視交叉上核のリズムは様々な位相でリズムを刻んでいる。低温暴露後に35℃復温すると、全ての視交叉上核のカルシウムリズムは同じ位相から再開する(左)。一方で、時計遺伝子の転写リズムは復温後でも位相が揃っていないが、数日間徐々にカルシウムリズムとの位相関係を回復し、同様の位相に集約してゆく(右)。
本研究の発見の意義
本研究結果は、長年の謎であった「冬眠時に概日リズム中枢のリズムが継続するか停止するか?」という素朴な科学的な疑問に対しての解答を示すものです。また概日リズムの分子メカニズムにおいて、時計遺伝子のみならず、細胞内カルシウムイオンの概日リズムも重要な役割を果たしていることを示しており、概日リズムおよび冬眠の研究分野における「基礎生物学的な価値」を有するものです。さらに本研究は、極限環境を生き抜くための生存戦略である「哺乳類冬眠」のメカニズムを探究することを通じて、「生命とは何か」という命題に挑むものです。
今後の研究の展望
本研究で開発した低温環境での細胞機能の光イメージング解析は、今後の冬眠の生理機能の研究に貢献する基盤技術となると考えられ、この方法を用いることで冬眠研究がさらに進むことが期待されます。一方で、本研究で細胞~組織レベルでの概日リズムの低温特性が明らかになったものの、冬眠動物の脳内で同様の現象が起きているかは不明であり、今後さらに研究を進める必要があります。概日リズム以外にも哺乳類の冬眠のメカニズムは未だ多くが解明されておらず、21世紀に残された大きな研究のフロンティアの1つです。冬眠のメカニズムを探究することで、これまで極めて狭い範囲の温度範囲でしか理解されてこなかった生理機能の理解が拡張され、これまで見過ごされてきた機能が明らかになることが期待されます。
用語説明
*1 概日リズム
地球上のあらゆる生物が持つ約24時間周期の生体リズム。体内時計、生物時計ともいう。
*2 時計遺伝子
体内時計のリズム作りだしている遺伝子。細胞内の時計遺伝子の発現と、遺伝子から作られるタンパク質の合成とその分解のサイクルによって概日リズムが生成される。2017年には時計遺伝子の同定に関わった3名の研究者にノーベル賞が授与された。
*3 視交叉上核(しこうさじょうかく)
哺乳類の概日リズムの中枢として役割を担っている脳領域。網膜からの外界の光情報を受け、視交叉上核で作り出された概日リズム情報を全身に送り出している。
研究サポート
本研究は、学術変革領域B「冬眠生物学」および学術変革領域A「冬眠生物学2.0」(20H05769, 23H04943, 榎木亮介、金尚宏、山口良文)、科学研究費補助金(20H05769, 20H03425, 22K19319, 23H04943, 榎木亮介; 20H05669, 20H00523, 根本知己; 20H05766, 23H04939, 23H04940, 山口良文)、ExCELLS計画研究(21-205; 榎木亮介) 等の支援を受けて実施されました。
掲載論文
雑誌名: iScience
論文名: Cold-induced Suspension and Resetting of Ca
2+ and Transcriptional Rhythms in the Suprachiasmatic Nucleus Neurons
著者: 榎木亮介*, 金尚宏, 清水貴美子, 小林憲太, 廣蒼太, 張菁圃, 中根達人, 石井宏和, 坂本丞, 山口良文, 根本知己 (*責任著者)
DOI:
https://doi.org/10.1016/j.isci.2023.108390
掲載URL:
https://www.cell.com/iscience/fulltext/S2589-0042(23)02467-7
お問い合わせ先
(本資料の内容に関するお問い合わせ)
自然科学研究機構 生命創成探究センター / 生理学研究所
准教授 榎木亮介
(広報に関するお問い合わせ)
自然科学研究機構 生命創成探究センター 研究戦略室
自然科学研究機構 生理学研究所 研究力強化戦略室
東海国立大学機構 名古屋大学 広報課
北海道大学 社会共創部広報課
リリース元
583,4698
4694
536,4695
4697
4695,4694,536,4697










