ポイント
・LGI3遺伝子の変異は知的発達症を引き起こすことが報告されていましたが、その機序は不明でした。
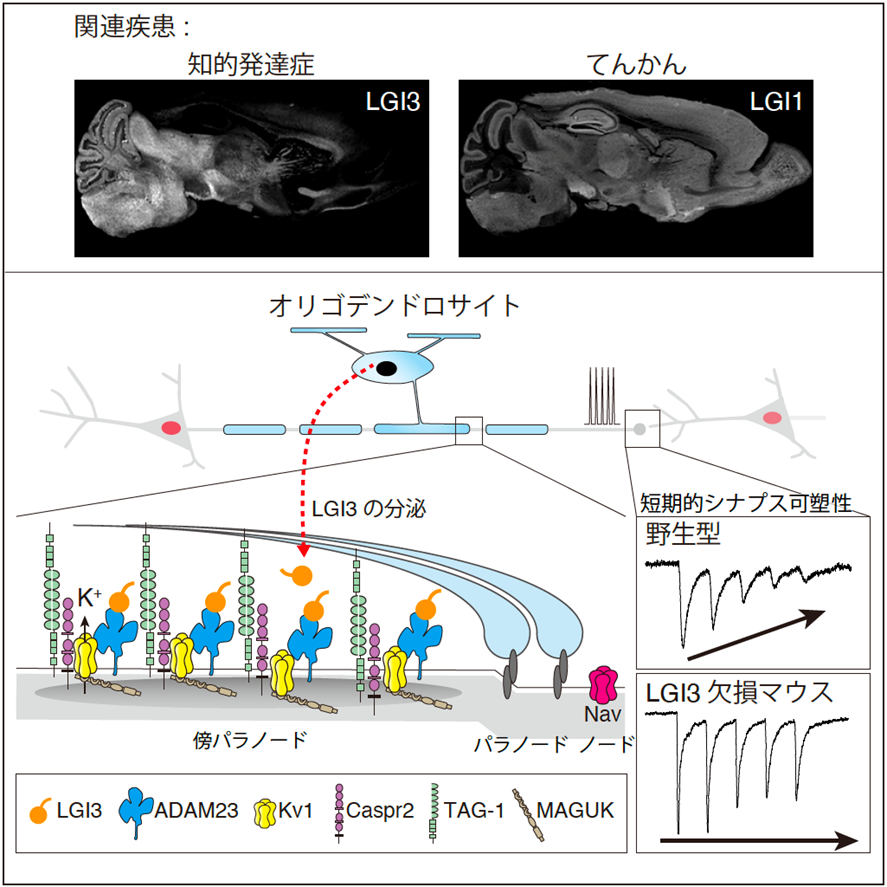
・本研究では、知的発達症の原因遺伝子産物(タンパク質)であるLGI3が脳内でグリア細胞の一種であるオリゴデンドロサイトから分泌され、神経突起上のADAM23という受容体を介して、電位依存性カリウムチャネル(Kv1チャネル)(*1) の分布および神経伝達を精密に制御していることが明らかとなりました。
・遺伝子変異によるLGI3の機能異常は、正常な神経伝達を阻害することにより、知的発達症を引き起こすと考えられます。
・本研究の成果であるLGI3とKv1チャネルによる神経伝達機構の解明は、今後の神経疾患の治療戦略の開発にも繋がると期待されます。
国立大学法人東海国立大学機構 名古屋大学大学院医学系研究科神経情報薬理学の宮﨑裕理 助教、深田優子 准教授、深田正紀 教授らの研究グループは、自然科学研究機構 生理学研究所の大塚岳 助教、平林真澄 准教授 らとの共同研究により、知的発達症の原因遺伝子産物(タンパク質)の一つであるLGI3が、脳内で髄鞘形成を担うオリゴデンドロサイトから分泌され、神経軸索上の受容体であるADAM23と結合することで電位依存性カリウムチャネル(Kv1チャネル)を制御し、正常な神経伝達に寄与していることを発見しました。
近年、LGI3遺伝子の変異が遺伝性の知的発達症を引き起こすことが報告されていましたが、その機序はこれまで明らかにされていませんでした。本研究では、LGI3が脳内で神経軸索の髄鞘化(*2)を担うオリゴデンドロサイトから分泌され、ADAM23という受容体と共に軸索局所(傍パラノード)に濃縮していることを明らかにしました。そして、LGI3とADAM23は、神経伝達を制御するKv1チャネルの安定化に寄与していることを見出しました。実際、LGI3を欠損させたマウスでは、傍パラノードでのKv1チャネルが減少し、軸索を伝わる活動電位が変化し、最終的には神経細胞間のシナプス伝達が異常となることが明らかとなりました。このような変化がLGI3遺伝子変異による知的発達症発症の原因となっていると考えられます。
これらの発見は、神経伝達の破綻によって引き起される知的発達症を含めた神経疾患発症メカニズムの解明に貢献すると共に、それらの疾患の治療戦略の創出にもつながることが期待されます。
本研究成果は、2024年1月8日付(日本時間1月9日午前1時)国際科学雑誌『Cell Reports』に掲載されました。 |
1. 背景
私達の脳は極めて複雑な情報処理を行っていますが、その過程には神経細胞をはじめとする種々の細胞が関わっています。正常な脳活動には、これらの細胞において様々なタンパク質が正しく機能することが重要であり、遺伝子変異などによるタンパク質の機能異常は多様な神経疾患を引き起こします。したがって、疾患と関連する遺伝子産物(タンパク質)の脳内における機能を明らかにすることは病態メカニズムを理解する上で極めて重要です。
LGI3は、LGI1からLGI4まで存在するLGIファミリー遺伝子に属しており、分泌タンパク質として働きます。それぞれの遺伝子変異は多様な神経疾患(てんかんや末梢神経の髄鞘低形成など)を引き起こすことが知られており、本研究グループはこれまでにLGIファミリー遺伝子変異による神経疾患発症機序の解明に取り組んできました。最近、ヒトの遺伝学的解析により、LGI3の変異が知的発達症を引き起こすことが報告されましたが、その病態機構は不明なままでした。
本研究では、1) LGI3タンパク質が脳内のどこに局在するか、また2) どのようなタンパク質と結合して機能しているのかを明らかにするとともに、3) LGI3の欠損が引き起こす生理学的な異常を調べることにしました。これらを通じて、LGI3が正常な脳活動にどのように寄与し、その機能破綻がどのようにして神経疾患を引き起こすのかを明らかにすることを目的としました。
2. 研究成果
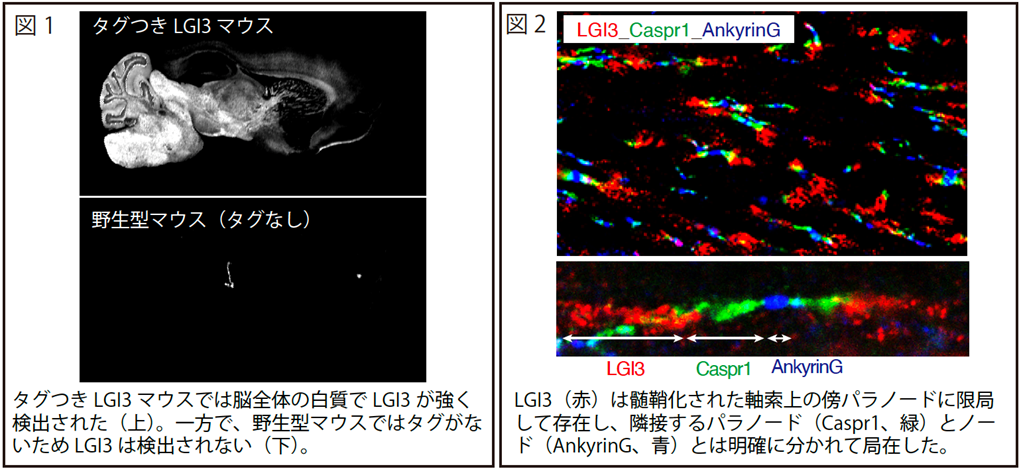
まず、タグ(目印)をつけたLGI3を発現するマウスをゲノム編集技術(*3)によって作製し、マウスの脳内におけるLGI3の局在を調べました。その結果、LGI3は神経軸索に髄鞘を形成するグリア細胞の一種(オリゴデンドロサイト)から分泌され、白質領域に強く分布していることを明らかにしました(図1)。さらに、LGI3の局在を詳細に調べたところ、LGI3は髄鞘化された神経軸索の特殊な部位(傍パラノード)に限局して存在していることが分かりました(図2)。
次に、マウス脳からLGI3タンパク質を精製し、ショットガン質量分析法(*4)によりLGI3結合タンパク質を網羅的に調べたところ、膜タンパク質であるADAM23や電位依存性カリウムチャネル(Kv1チャネル)等が結合していることが明らかとなりました。重要なことに、LGI3欠損マウスにおいては、傍パラノードにおけるADAM23やKv1チャネルのクラスター形成が著しく阻害され(図3)、髄鞘化された軸索上の活動電位伝播(*5)や神経細胞間のシナプス伝達効率の変化[短期的シナプス可塑性(*6)]が阻害されていることが分かりました(図4)。
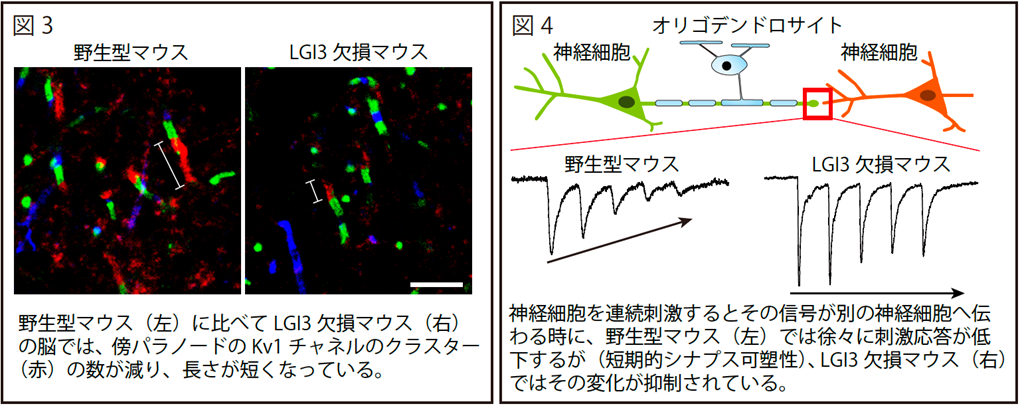
これらの結果から、ヒトの脳内でもオリゴデンドロサイトから分泌されたLGI3が、軸索上の傍パラノードにおいてKv1チャネルを制御し、正常な活動電位伝播やシナプス伝達の遂行に寄与していると考えられます。一方、遺伝子変異によりLGI3タンパク質の機能が破綻すると、これらの生理的な神経伝達が破綻し、知的発達症の発症に繋がるのではないかと考えられます。
3. 今後の展開
本研究で、知的発達症の原因タンパク質であるLGI3は、髄鞘化された神経軸索の傍パラノードでKv1チャネルを制御することにより、正常な神経伝達に寄与していることが明らかとなりました。一方で、他のLGIファミリータンパク質は傍パラノード以外にもシナプスや軸索起始部(*7)などの異なる細胞内領域でもADAM23ファミリーと結合することがわかっており、その一部はKv1チャネルと相互作用していると考えられています。今後は、LGIファミリー/ADAM23ファミリー/Kv1チャネルからなるタンパク質複合体の詳細な結合様式を明らかし、このタンパク質群が担う生理的な機能の全容を解明したいと考えています。さらに、これらの研究を通じて、Kv1チャネル機能やタンパク質の安定性を高める方法を見出すことで、LGI3遺伝子変異による知的発達症を含むKv1機能異常を原因とした神経疾患治療戦略の創出に繋がることが期待されます。
4. 用語説明
*1)電位依存性カリウムチャネル(Kv1チャネル):神経細胞や心筋細胞に発現し、細胞膜の電位変化を感知して細胞内のカリウムイオンを選択的に透過させるイオンチャネルで、神経細胞や心筋細胞の活動電位の再分極を担う。
*2)髄鞘(化):神経細胞の軸索周囲にグリア細胞の一種であるオリゴデンドロサイトの一部が巻き付いた層状の構造。軸索上の活動電位(電気的信号)を素早く伝えることができる。
*3)ゲノム編集技術:目的遺伝子のDNAを書き換えたり、任意のDNA配列を挿入したりする技術。
*4)ショットガン質量分析法:高感度の質量分析計(LC-MS/MS)による測定とデータベース検索により、試料中に含まれるタンパク質を網羅的に同定する方法。
*5)活動電位伝播:神経細胞の軸索上を活動電位が伝わっていくこと。
*6)短期的シナプス可塑性:神経細胞同士のつなぎ目(シナプス)を、化学物質を介して情報が伝播することをシナプス伝達と呼ぶ。短時間にシナプス伝達効率が変化することを短期的シナプス可塑性という。
*7)軸索起始部:神経細胞の軸索突起の内、細胞体に近い部分で、イオンチャネルや膜タンパク質などが密集し活動電位の発生部位としての役割をもつ。
助成金など
本研究は、国立研究開発法人日本医療研究開発機構(AMED)の「脳とこころの研究推進プログラム 領域横断的かつ萌芽的脳研究プロジェクト」 (研究開発課題名:LGI1-ADAM22分子経路の機能破綻による高次脳機能障害の病態解明)、「難治性疾患実用化研究事業 疾患基礎基盤研究プロジェクト」(研究開発課題名:VGKC複合体を標的とする神経疾患の病態解明) 、日 本 学 術 振 興 会 科 学 研 究 費 補 助 金 (22K15208、21K19390 、22H02723、23H00374、23H04243、23K18228)、および武田科学振興財団の支援を受けて行われました。
論文情報
雑誌名:Cell Reports
論文タイトル:Oligodendrocyte-derived LGI3 and its receptor ADAM23 organize juxtaparanodal Kv1 channel clustering for short-term synaptic plasticity
著者名・所属名:
Yuri Miyazaki,
1,2 Takeshi Otsuka,
3,4 Yoko Yamagata,
5 Toshihiro Endo,
6 Makoto Sanbo,
7 Hiromi Sano,
8 Kenta Kobayashi,
4,9 Hiroki Inahashi,
2 Hans-Christian Kornau,
10,11 Dietmar Schmitz,
10,11 Harald Prüss,
10,12,13 Dies Meijer,
14,15 Masumi Hirabayashi,
4,7 Yuko Fukata,
2,16 Masaki Fukata
1,2,4
1. Division of Neuropharmacology, Nagoya University Graduate School of Medicine, Nagoya 466-8550, Japan.
2. Division of Membrane Physiology, Department of Molecular and Cellular Physiology, National Institute for Physiological Sciences, National Institutes of Natural Sciences, Okazaki, Aichi 444-8787, Japan.
3. Section of Cellular Electrophysiology, National Institute for Physiological Sciences, National Institutes of Natural Sciences, Okazaki, Aichi 444-8787, Japan.
4. Graduate Institute for Advanced Studies, SOKENDAI, Okazaki, Aichi 444-8585, Japan.
5. Section of Multilayer Physiology, National Institute for Physiological Sciences, National Institutes of Natural Sciences, Okazaki, Aichi 444-8585, Japan.
6. Phenovance LLC, Kashiwa, Chiba 277-0882, Japan.
7. Section of Mammalian Transgenesis, Center for Genetic Analysis of Behavior, National Institute for Physiological Sciences, National Institutes of Natural Sciences, Okazaki, Aichi 444-8787, Japan.
8. Division of Behavioral Neuropharmacology, International Center for Brain Science, Fujita Health University, Toyoake, Aichi 470-1192, Japan.
9. Section of Viral Vector Development, Center for Genetic Analysis of Behavior, National Institute for Physiological Sciences, National Institutes of Natural Sciences, Okazaki, Aichi, 444-8585, Japan.
10. German Center for Neurodegenerative Diseases (DZNE) Berlin, Berlin, Germany.
11. Neuroscience Research Center (NWFZ), Cluster NeuroCure, Charité-Universitätsmedizin Berlin, corporate member of Freie Universität Berlin and Humboldt-Universität zu Berlin, Berlin, Germany.
12. Helmholtz Innovation Lab BaoBab (Brain antibody-omics and B-cell Lab), Berlin, Germany.
13. Department of Neurology and Experimental Neurology, Charité-Universitätsmedizin Berlin, corporate member of Freie Universität Berlin and Humboldt-Universität zu Berlin, Berlin, Germany.
14. Centre for Discovery Brain Sciences, University of Edinburgh, Edinburgh. UK.
15. Muir Maxwell Epilepsy Centre, University of Edinburgh, Edinburgh, UK.
16. Division of Molecular and Cellular Pharmacology, Nagoya University Graduate School of Medicine, Nagoya 466-8550, Japan.
DOI: 10.1016/j.celrep.2023.113634
お問い合わせ
【研究者所属】
東海国立大学機構 名古屋大学大学院医学系研究科 神経情報薬理学
自然科学研究機構 生理学研究所 生体膜研究部門(兼任)
教授 深田 正紀(ふかた まさき)
【報道連絡先】
東海国立大学機構 名古屋大学医学部・医学系研究科 総務課総務係
TEL:052-744-2804 FAX:052-744-2785
E-mail:iga-sous@t.mail.nagoya-u.ac.jp
自然科学研究機構 生理学研究所
研究力強化戦略室
E-mail: pub-adm@nips.ac.jp
542
500,533,535,536,542,490