研究成果の概要
名古屋市立大学大学院医学研究科脳神経科学研究所の澤本和延教授(生理学研究所兼任)、松本真実(同特任助教)らの研究グループは、生後のマウスの脳内において、新しく生まれた神経細胞(新生ニューロン)が集団で移動する際に、細胞と細胞の間に広い隙間を作りながら高速で移動していることを発見しました。一方で、脳梗塞によって脳が傷害を受けた時には、この隙間を減少させるノイラミニダーゼという酵素が増えることで、ニューロンが移動しにくくなってしまうことを見出しました。さらに、抗インフルエンザ薬として用いられているノイラミニダーゼの働きを抑える薬剤を投与することで、ニューロンが移動しやすくなり、傷害脳におけるニューロン再生や機能回復が促進されました。また、ヒトに近い霊長類でも同様の結果が得られることが示されました。
研究のポイント
-
脳梗塞治療は急性期の治療以外には確立されておらず、傷害によって失われたニューロンを根本的に再生させる方法は現在のところ確立されていません。
-
傷害を受けた脳では、神経幹細胞から産生された新生ニューロンの一部が、傷害部位へ移動し、ニューロン再生に貢献しますが、その移動効率は低く、脳機能回復には至りません。
-
本研究では、正常な脳内を移動する新生ニューロンの間には隙間が存在し、接着しすぎないようにすることで高速移動を可能にしていることを発見しました。
-
傷害を受けた脳内の新生ニューロンが動きにくい原因として、ノイラミニダーゼが増加することで、新生ニューロン間の隙間が減少し、細胞接着が過剰になることを突き止めました。
-
ノイラミニダーゼの働きを抑える抗インフルエンザ薬を投与することにより、新生ニューロンの移動およびニューロン再生が促進し、脳傷害によって失われた脳機能が回復することを明らかにしました。
-
抗インフルエンザ薬を使って脳梗塞の根本的治療に成功した世界初の研究であり、臨床への応用が期待できます。
背景
現在普及している脳梗塞の血管内治療は、発症早期の患者さんに限られています。脳梗塞を根本的に治療するには、失われたニューロンを再生させることが必要と考えられますが、そのような治療は未だ確立されておりません。近年、再生医療の技術が発達し、例えば、細胞などを移植する治療技術の臨床応用が期待されています。しかし、これらのアプローチには、侵襲性の高さや治療効果が限局してしまうなどの課題があります。より侵襲性が低く、広範囲な治療効果が得られる治療法が開発されれば、脳の再生医療におけるブレイクスルーに繋がると期待されます。
神経細胞(ニューロン)を産み出す幹細胞は、胎生期のみならず生後脳の限られた領域にも存在しています。正常な脳内において、神経幹細胞から産生された新生ニューロンは鎖状に連なって、脳内を高速移動し、目的地に到達すると成熟し、脳機能の維持に関わっていることが知られています。一方で、脳傷害が生じた際には、一部の新生ニューロンが傷害部へと移動し、失われたニューロンを再生することが報告されていますが、新生ニューロンの移動効率は低く、傷害によって失われてしまった脳機能を回復させることはできません。なぜ、正常な脳内を移動する新生ニューロンは高速で移動することができるのか。また、なぜ、傷害脳内を移動する新生ニューロンの移動効率が低いのかは、未だ明らかにされていません。これらを明らかにすることができれば、傷害脳内を移動する新生ニューロンを効率よく傷害部へ供給することができるかもしれません。
研究の成果
本研究ではまず、なぜ正常な脳内を移動する新生ニューロンが高速で移動することができるかを調べました。三次元電子顕微鏡による解析により、鎖状に連なっている新生ニューロン同士の間に広い隙間が存在していることが明らかになりました。また、この隙間はポリシアル酸 (PSA)*
1によって維持されており、これにより、新生ニューロン同士の間に適度な接着状態が維持されていることが明らかとなりました。以上の結果から、正常脳内を移動する新生ニューロンはPSAにより適度な隙間を形成することで、脳内を高速に移動することができることがわかりました。
次に、なぜ傷害脳内を移動する新生ニューロンの移動効率が低いのかを調べるために、三次元電子顕微鏡による解析を行ったところ、正常脳内を移動する新生ニューロンに比べ、傷害脳内を移動する新生ニューロンでは隙間が減少し、細胞接着が過剰になっていることが明らかとなりました。数理モデルによるシミュレーション解析によって、細胞接着が過剰になることで、ニューロン移動が低下してしまうことが予測されました。なぜ傷害脳内を移動する新生ニューロンでは細胞接着が過剰になってしまうのかを調べるために、隙間の維持に関与しているPSAレベルを調べたところ、傷害脳内を移動する新生ニューロンにおいてPSAレベルが減少していることがわかりました。さらに、PSAを切断するノイラミニダーゼ*
2の発現が脳傷害によって上昇していることが判明しました。これらの結果から、傷害脳内を移動する新生ニューロンでは、脳傷害によってPSAを切断するノイラミニダーゼが増加することでPSAレベルが低下し、その結果、過剰な細胞接着が生じることで、ニューロン移動の効率が低下していることが明らかになりました (図A)。
最後に、傷害脳において増加したノイラミニダーゼを抑制することで、新生ニューロンの移動を促進し、効率よく傷害部へ新生ニューロンを供給し、脳機能再生に寄与できるかを調べました。ノイラミニダーゼ阻害薬である抗インフルエンザ薬zanamivir*
3を脳梗塞モデルマウスに投与したところ、PSAの減少が抑制され、傷害部への新生ニューロンの移動が促進することが明らかとなりました。傷害部に多くの新生ニューロンを供給することにより、成熟するニューロンも増加することがわかりました。また、脳梗塞によって低下する歩行機能への影響を調べたところ、阻害剤を投与したマウスでは歩行機能の回復が認められました。さらに、マウスだけではなく、ヒトに近い霊長類傷害脳においても、zanamivir投与により、PSAの減少が抑制され、傷害部への新生ニューロンの移動が促進することがわかりました。以上の結果から、脳傷害によって増加してしまうノイラミニダーゼの働きを阻害することで、新生ニューロンの移動促進、ニューロン再生促進、そして脳機能の回復が可能であることが示されました (図B)。
研究の意義と今後の展開や社会的意義など
本研究は、正常な脳内の新生ニューロン移動のメカニズムを解明するとともに、傷害を受けた脳内の新生ニューロン移動効率の低下の原因を突き止めることに繋がりました。また、明らかにされたメカニズムを応用することで、脳傷害治療の新たな可能性を示しました。今回の研究成果は、未だ根本的な治療方法が確立されていない脳疾患に対し、侵襲性が低く、広範囲な治療効果が認められる新しい治療法として、応用されることが期待されます。
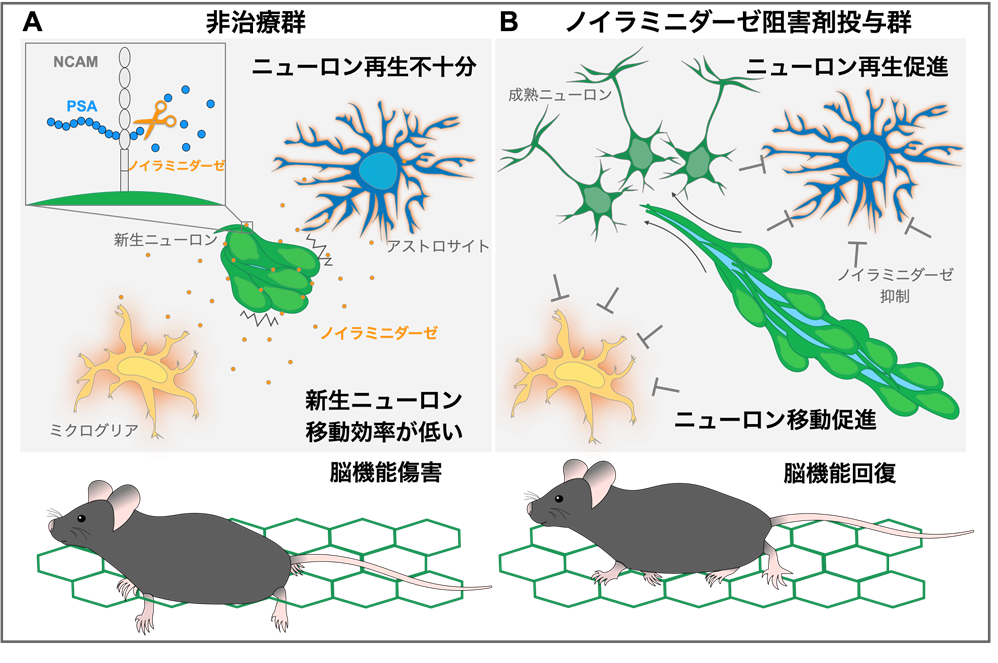
図:本研究の成果
© 2024 Matsumoto et al. Originally published in EMBO Molecular Medicine
DOI番号:10.1038/s44321-024-00073-7
A. 傷害を受けた脳では、ノイラミニダーゼが増加することで、新生ニューロン間の隙間の維持に重要なPSAが減少し、細胞接着が増加してしまう。これにより、新生ニューロンの移動効率が低下し、非治療群ではニューロン再生が不十分であることから、脳機能傷害が生じる。
B. ノイラミニダーゼ阻害剤を投与することにより、新生ニューロンにおけるPSA減少を阻止できる。これにより、新生ニューロンの移動が促進され、より多くの新生ニューロンが再生することで、脳機能回復が促進する。
用語解説
*1 ポリシアル酸(PSA):新生ニューロンの細胞表面に存在するneural cell adhesion molecule(NCAM)に付加されている糖鎖。PSAの存在によりNCAM同士の接着が抑制されることで細胞接着を負に制御する分子として知られている。
*2ノイラミニダーゼ:シアル酸を切断する酵素として知られている。
*3 zanamivir:ノイラミニダーゼ阻害剤の一種。抗インフルエンザ薬として臨床で使用されている。商品名:リレンザ。
研究助成
本研究は、日本医療研究開発機構(AMED)の革新的先端研究開発支援事業(AMED-CREST)「生体組織の適応・修復機構の時空間的解析による生命現象の理解と医療技術シーズの創出」研究開発領域における研究開発課題「ニューロン移動による傷害脳の適応・修復機構とその操作技術」(研究開発代表者:澤本和延)、再生医療実現拠点ネットワークプログラム「幹細胞・再生医学イノベーション創出プログラム」研究開発事業における「脳細胞の移動・再生促進技術の開発」(研究開発代表者:澤本和延)、日本学術振興会研究拠点形成事業(先端拠点形成型)「国際ニューロン新生研究拠点」、文部科学省・日本学術振興会 科学研究費助成事業、武田科学振興財団、日東学術振興財団などによる助成を受けて行われました。
論文タイトル
Neuraminidase inhibition promotes the collective migration of neurons and recovery of brain function
著者
松本真実1, 2、 松下勝義3, 羽根正弥4、Wen Chentao 5, 6、 榑松千紘1、 太田晴子1, 7、 Huy Bang Nguyen 8, 9、 Truc Quynh Thai 8, 10、 Vicente Herranz-Perez 11, 12、 澤田雅人1, 2、 藤本仰一3、Jose Manuel Garcia-Verdugo 11、木村幸太郎 5、 石龍徳 13, 14、 佐藤ちひろ 4、 大野伸彦 15, 16、 澤本和延 1,2, a
1: 名古屋市立大学大学院 医学研究科 脳科学研究所 神経発達・再生医学分野
2: 自然科学研究機構 生理学研究所 神経発達・再生機構研究部門
3: 広島大学 統合生命科学研究科 数理生命科学プログラム
4: 名古屋大学 糖鎖生命コア研究所 統合生命医科学糖鎖研究センター 分子生理・動態部門
5: 名古屋市立大学大学院 理学研究科
6: 理化学研究所 生命機能科学研究センター 発生動態研究チーム
7: 名古屋市立大学大学院 医学研究科 麻酔科学・集中治療医学分野
8: 自然科学研究機構 生理学研究所 電子顕微鏡室
9: Department of Anatomy, Faculty of Medicine, University of Medicine and Pharmacy at Ho Chi Minh City
10: Department of Histology-Embryology- Genetics, Faculty of Basic Medical Sciences, Pham Ngoc Thach University of Medicine
11: Laboratory of Comparative Neurobiology, Cavanilles Institute, University of Valencia
12: Department of Cell Biology, Functional Biology and Physical Anthropology, University of Valencia
13: 順天堂大学医学部 解剖学 生体構造科学講座
14: 東京医科大学医学科組織 神経解剖学分野
15: 自治医科大学 医学部解剖学講座 組織学部門
16: 自然科学研究機構 生理学研究所 超微形態研究部門
a: 責任著者
掲載学術誌
学術誌名 : EMBO Molecular Medicine
DOI番号:10.1038/s44321-024-00073-7
お問い合わせ
【研究に関するお問い合わせ】
名古屋市立大学大学院医学研究科脳神経科学研究所 教授 澤本和延
【報道に関するお問い合わせ】
名古屋市立大学 病院管理部経営課
自然科学研究機構 生理学研究所 研究力強化推進室(広報)
連携できる企業様でご関心をお持ちいただける場合のご連絡につきましては、下記の問い合わせ先にて承ります。
【産学連携・共同研究等に関するお問い合わせ】
名古屋市立大学 産学官共創イノベーションセンター
(本部棟2階 教育研究部研究推進課課内)
リリース元


公立大学法人 名古屋市立大学
自然科学研究機構 生理学研究所
3559


