発表のポイント
-
アルツハイマー病の原因物質であるアミロイドβ(Aβ)の家族性変異「Tottori型(D7N変異)」について、国際宇宙ステーションの微小重力環境を活用した実験により、世界で初めてその線維構造の解明に成功しました。
-
微小重力環境下では、地上で優先的に形成される無秩序な凝集体の生成が抑制され、Aβが効率的に線維化することで、高精度な構造解析が可能となりました。
-
クライオ電子顕微鏡による解析の結果、D7N変異によりN末端領域が構造化されず、線維のコア構造の安定性が失われることで異常凝集が促進される分子メカニズムが明らかとなりました。
研究の背景
アミロイド
β(A
β)注1) は、アルツハイマー病における脳内の異常タンパク質沈着物の主成分です。A
βが線維状に自己集合する過程(線維化)は、疾患発症の鍵を握ると考えられています。これまでに、A
β線維の多様な構造型が報告されてきましたが、家族性アルツハイマー病に関連する変異型A
βの線維構造については、解明が進んでいないものが多く残されています。
Tottori型 注2) と呼ばれる家族性変異は、A
βのN末端領域に位置するアスパラギン酸7番(D7)がアスパラギン(N)に置き換わることで、通常とは異なる凝集挙動を示すことが知られています。しかしこの変異型は、地上条件ではかたちの整ったアミロイド線維を形成しにくく、代わりに無秩序なアモルファス凝集体 注3) となってしまうため、従来の手法では構造解析が困難でした。このような「解析不能な凝集体」の構造を解明するには、新たなアプローチが求められていました。
研究の成果
自然科学研究機構・生命創成探究センター(ExCELLS)を中心とする研究グループは、国際宇宙ステーション「きぼう」日本実験棟を活用し、アルツハイマー病に関連する家族性変異型アミロイド
β(A
β)「Tottori型(D7N変異)」の線維形成と構造解析に世界で初めて成功しました。
地上では無秩序な凝集体(アモルファス凝集体)が優先的に形成され、構造解析が困難であったTottori型A
β40に対して、微小重力 注4) 環境下ではアモルファス凝集が抑えられ、効率的な線維化が促進されました。これにより、クライオ電子顕微鏡 注5) を用いた詳細な構造解析が可能となりました。得られた線維構造では、N末端領域が柔軟で秩序立った構造をとっていないことが確認され、D7N変異により野生型A
βで見られるN末端によるコア構造の安定化機構が失われていることが示唆されました。この変異は、電荷バランスの変化や疎水性の増加を通じて、アモルファス凝集を促進し、線維化の妨げとなっていると考えられます。しかし、微小重力環境では、重力に起因する対流や沈降が抑えられることで、アモルファス凝集の発生が制限され、構造が収束した高品質な線維が形成されました。
この成果は、A
β線維形成における自由エネルギー地形の解明に新たな視座を提供するだけでなく、家族性アルツハイマー病の分子機構解明や、将来的な診断・治療標的の開発にも貢献が期待されます。
成果の意義および今後の展開
本研究は、微小重力環境がタンパク質凝集過程に与える影響を構造レベルで実証した初めての成果であり、A
βの病態関連変異体の構造生物学における新たな展開を示すものです。D7N変異によってA
βのN末端が線維コアの安定化に寄与できなくなり、その結果としてアモルファス凝集が誘導されるという、新たな凝集制御メカニズムが明らかになりました。本成果は、家族性アルツハイマー病の病態解明や構造に基づく創薬戦略に貢献する可能性があります。今後は、他のA
β変異体や病態関連タンパク質に対しても、微小重力下での構造解析を進め、凝集体の構造多様性を包括的に明らかにしていくことが期待されます。
用語説明
注1)アミロイドβ(Aβ):脳内でアミロイド線維を形成するペプチドで、アルツハイマー病の主要な原因物質とされる。
注2)Tottori型(D7N変異):アミロイドβの7番目のアスパラギン酸(D)がアスパラギン(N)に変異した、家族性アルツハイマー病の一型。
注3)アモルファス凝集体:アモルファス凝集体:秩序だった線維構造ではなく、ランダムに凝集した非線維性のタンパク質集合体。
注4)微小重力:微小重力:地球の重力をほとんど感じない環境。宇宙空間では重力による対流や沈降が抑制される。
注5)クライオ電子顕微鏡:クライオ電子顕微鏡:凍結した試料を電子線で観察し、ナノメートル〜原子レベルの構造を可視化する手法。
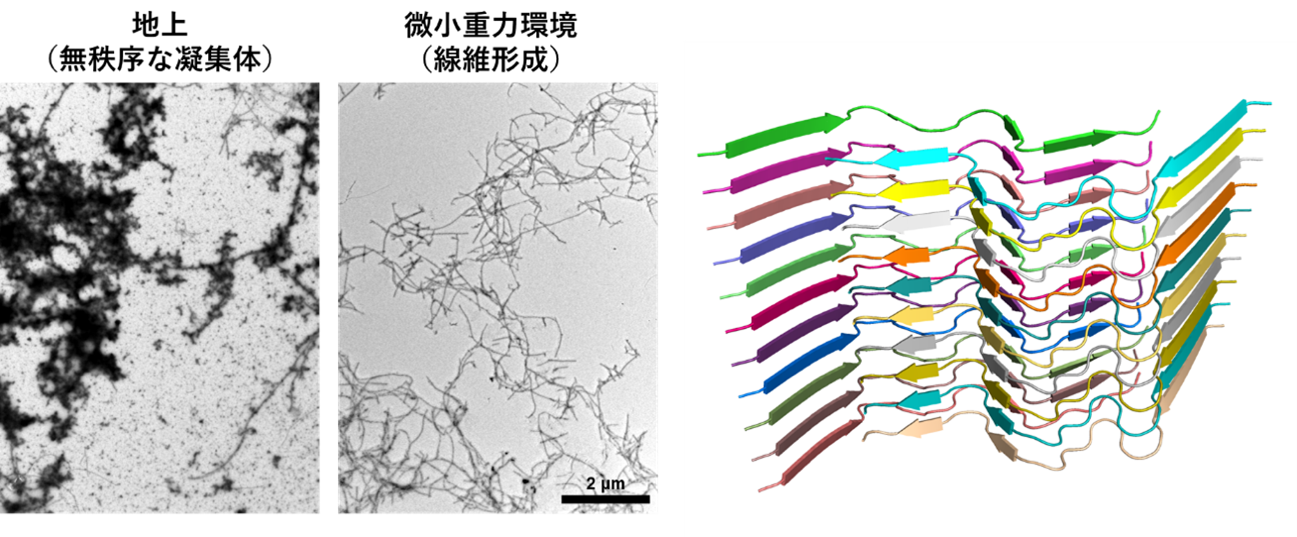
図:(左) Tottori型アミロイドβの集合形態。地上では無秩序な凝集体ができるのに対し、微小重力下では線維形成がみられた。(右)微小重力下で形成したTottori型アミロイド線維の構造(コア構造)。N末端領域は柔軟で秩序立った構造をとっていないことが明らかとなった。
論文情報
タイトル: Microgravity-Assisted Exploration of the Conformational Space of Amyloid β Affected by Tottori Type Familial Mutation D7N
著者: Maho Yagi-Utsumi, Saeko Yanaka, Raymond N. Burton-Smith, Chihong Song, Christian Ganser, Chiaki Yamazaki, Haruo Kasahara, Toru Shimazu, Takayuki Uchihashi, Kazuyoshi Murata, Koichi Kato
掲載誌: ACS Chemical Neuroscience
DOI: 10.1021/acschemneuro.5c00217
論文公開日: 2025年6月25日(水)午前3時00分(日本時間)
著者情報
矢木真穂(生命創成探究センター、分子科学研究所、名古屋市立大学)、谷中冴子(生命創成探究センター、分子科学研究所、名古屋市立大学)、Raymond N. Burton-Smith(生命創成探究センター、生理学研究所)、Chihong Song(生命創成探究センター、生理学研究所)、Christian Ganser(生命創成探究センター)、 山崎千秋(宇宙航空研究開発機構 有人宇宙技術部門 有人宇宙技術センター)、笠原春夫(宇宙航空研究開発機構 有人宇宙技術部門 きぼう利用センター)、嶋津徹(一般財団法人 日本宇宙フォーラム)、内橋貴之(生命創成探究センター、名古屋大学、東海国立大学機構 糖鎖生命コア研究所)、村田和義(生命創成探究センター、生理学研究所)、加藤晃一*(生命創成探究センター、分子科学研究所、名古屋市立大学)
(*責任著者)
研究サポート
本研究は、以下の助成金により支援されました。
AMED創薬等先端技術支援基盤プラットフォーム(JP24ama121005、JP21am0101072)、
文部科学省 共同利用・共同研究システム形成事業 学際領域展開ハブ形成プログラム(JPMXP1323015482)、科学研究費補助金(JP19K07041 矢木真穂)、JST戦略的創造研究推進事業さきがけ(JPMJPR22AC 矢木真穂)、名古屋市立大学特別研究奨励費(2212008、2222004、2412012 矢木真穂)、 生命創成探究センター共同利用研究(24EXC601、22EXC601、22EXC354)、生理学研究所共同利用研究(24NIPS128、23NIPS107、22NIPS106、21-142、20-146)
お問い合わせ
<研究に関するお問い合わせ>
自然科学研究機構 生命創成探究センター/分子科学研究所 教授
名古屋市立大学大学院薬学研究科 特任教授
加藤 晃一
<広報に関するお問い合わせ>
自然科学研究機構 生命創成探究センター(ExCELLS)研究力強化戦略室
自然科学研究機構 分子科学研究所 研究力強化戦略室 広報担当
公立大学法人 名古屋市立大学 経営企画部 広報室 広報係
自然科学研究機構 生理学研究所 研究力強化戦略室
国立大学法人東海国立大学機構 名古屋大学 総務部広報課
リリース元




大学共同利用機関法人 自然科学研究機構 生命創成探究センター
大学共同利用機関法人 自然科学研究機構 分子科学研究所
公立大学法人 名古屋市立大学
大学共同利用機関法人 自然科学研究機構 生理学研究所
国立大学法人東海国立大学機構 名古屋大学
5116