研究の概要
大学共同利用機関法人 自然科学研究機構 生命創成探究センター(ExCELLS)/生理学研究所(NIPS)の李明亮(Lee Ming-Liang)特任助教、張菁圃(Chang Ching-Pu)特任研究員、根本知己 教授、榎木亮介 准教授らの研究グループは、熊本大学の戸田知得 准教授との共同研究により、体温低下そのものが全身の糖代謝を制御するという新たな仕組みを明らかにしました。
本研究では、冬眠様状態を人工的に誘導するマウスモデルを用い、体温を一時的に低下させることで、インスリンの効きにくさ(インスリン抵抗性)と、絶食中にも関わらず血糖値が下がらないという『糖尿病に似た一時的な代謝異常』が出現することを初めて明らかにしました。また、環境温度を上昇させてマウスの体温を元のレベルまで戻すと、これらの代謝異常が急速かつ完全に回復することも確認されました。これにより、体温が代謝の「結果」ではなく「原因」として機能する可能性を示しています。
冬眠や低代謝状態のメカニズムの理解を進めるとともに、糖尿病や肥満といった代謝疾患に対する新たな治療戦略の手がかりになることが期待されます。また救急医療、臓器保護、さらには将来的な宇宙空間での長期滞在など、極限環境における「代謝制御戦略」の応用にもつながる可能性があります。
本研究成果は、国際科学雑誌 Nature Communications (日本時間2025年7月10日18時解禁) にオンライン掲載されました。
発表のポイント
-
体温低下そのものが、インスリン抵抗性と高血糖を誘導することを世界で初めて実証。
-
マウスの人工冬眠モデルを用い、全身の主要臓器での糖利用が低下し、活動量とエネルギー消費も大幅に抑制されることを発見。
-
再加温によりこれらの代謝異常が迅速かつ可逆的に回復し、体温が代謝制御の上流因子である可能性を示唆。
-
本研究は、糖尿病の新たな理解を促すとともに、低代謝制御の医療・宇宙環境への応用可能性を示す重要な知見となる。
研究の詳しい内容
1. 背景
糖代謝異常は、糖尿病や肥満といった生活習慣病の中心的な病態であり、現代社会における重大な健康問題となっています。これらの疾患においては、インスリン抵抗性[*1]や高血糖状態が慢性的に続くことが、心血管疾患や腎機能障害などの合併症につながるとされています。こうした代謝異常の新たな理解は、病態解明や治療戦略の開発に直結する重要な課題です。
一方、動物の冬眠状態では、著しい低体温と代謝抑制が自然に生じるにもかかわらず、臓器障害や炎症反応を伴わずに長期間の省エネルギー状態を維持することが知られています。冬眠動物はこのような代謝状態を可逆的にコントロールできるため、その仕組みの解明は医療や宇宙生理学への応用の鍵となります。
本研究では、人工冬眠モデル(QIH:Q-neuron-induced hypothermia and hypometabolism)[*2] を用いて、体温低下が糖代謝に与える影響を詳細に検証しました。
2. 本研究の手法と成果
研究グループは、マウスの視床下部に存在するQニューロンを化学遺伝学的手法により活性化し、深部体温を23℃付近にまで低下させる人工冬眠状態を誘導しました。QIH状態のマウスでは、絶食中にもかかわらず血糖値とインスリン濃度の上昇が認められ、インスリンの作用が効きにくくなっていることを示すインスリン抵抗性の兆候が顕著に見られました(図1)。
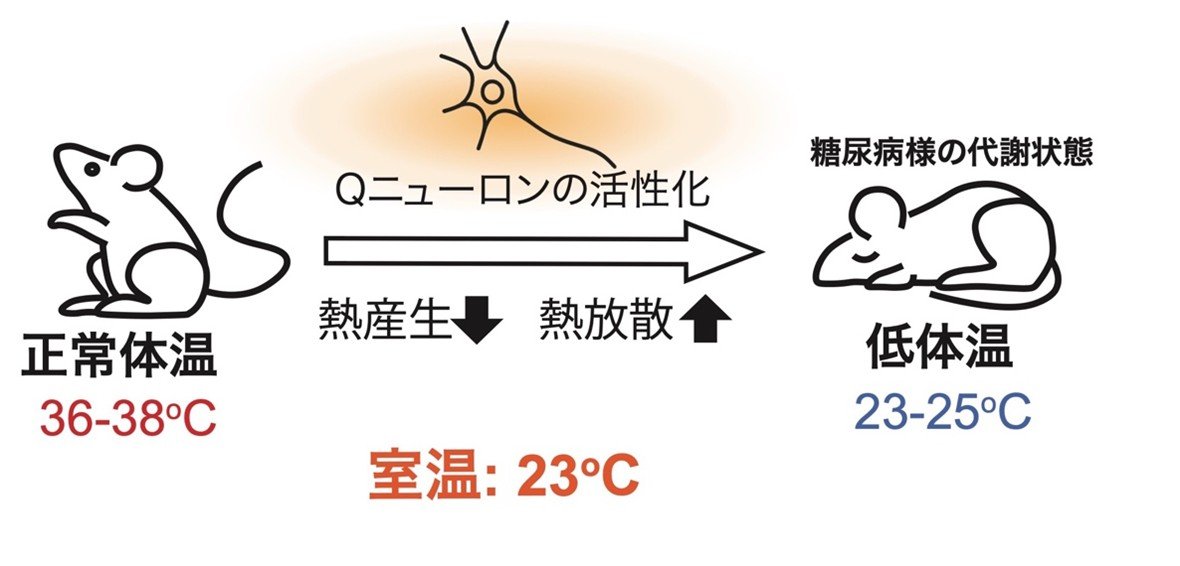 図1. Qニューロンの人工的な活性化は、熱産生を低下させ、熱放散を促進し、体温を室温近くまで大きく低下させる。この低体温状態には、糖尿病に類似した代謝状態が伴う。
図1. Qニューロンの人工的な活性化は、熱産生を低下させ、熱放散を促進し、体温を室温近くまで大きく低下させる。この低体温状態には、糖尿病に類似した代謝状態が伴う。
さらに、主要なエネルギー消費臓器である褐色脂肪組織 [*3]、骨格筋、心臓、大脳皮質におけるグルコース取り込み量が大幅に減少し、マウスの活動量やエネルギー消費も極端に低下していることが明らかとなりました。これらは、糖尿病と類似した全身的な代謝異常状態といえます。
注目すべきは、Qニューロンの活性化を維持したまま、周囲温度を上げてマウスを33-34℃付近まで再加温することで、血糖値やインスリン濃度、行動活動が急速に正常化し、代謝状態も完全に回復した点です(図2)。これは、QIHにおける代謝異常の主因がQニューロンの神経活動ではなく、体温の低下そのものであることを強く示唆します。
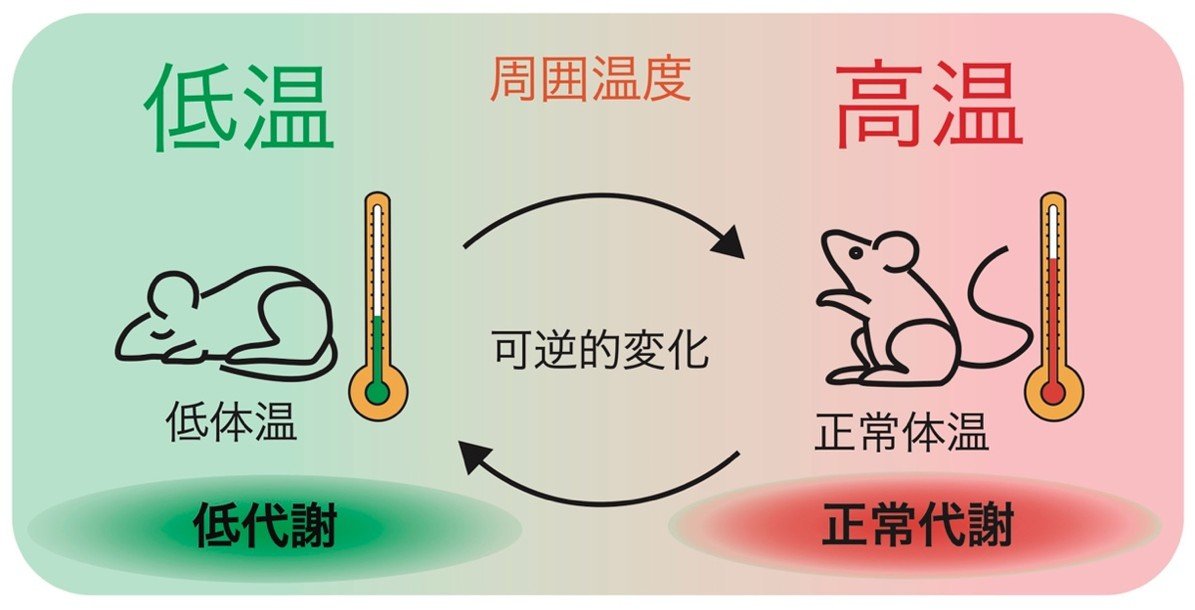 図2. 環境温度を上昇させることで、Qニューロンにより低体温状態となったマウスの体温が回復し、低代謝状態も元に戻る。この結果は、体温が代謝の調節において重要な要因であることを示唆している。
図2. 環境温度を上昇させることで、Qニューロンにより低体温状態となったマウスの体温が回復し、低代謝状態も元に戻る。この結果は、体温が代謝の調節において重要な要因であることを示唆している。
また、熱産生の主役である褐色脂肪組織をあらかじめ切除したマウスにおいても、同様の代謝異常が再現されたことから、この作用は局所的な熱産生機構に依存せず、全身性の現象であることが確認されました。
3. 本研究の学術的意義および研究の展望
本研究は、これまで一方向的に捉えられてきた「代謝が体温を調整する」という理解に対し、「体温が代謝を制御する」という新たな視点を提示するものであり、恒温動物におけるエネルギー代謝の基盤的理解を大きく進展させる成果です。
また、自然界で観察される冬眠状態を人工的に再現し、その可逆的な代謝調節機構を明らかにした点において、冬眠生理学・神経代謝学・温度生理学の学際領域に対しても貢献する意義の高い研究といえます。今後は、温度感受性代謝ネットワークの分子機構の解明や、よりヒト応用に近いモデル系への展開が期待されます。
4. 研究の社会的意義・社会への波及効果
糖尿病や肥満などの慢性代謝疾患は世界的に患者数が増加しており、生活の質や医療費に多大な影響を及ぼしています。本研究は、薬剤を用いず「体温」という生理的な因子を操作することで、代謝を一時的かつ可逆的に制御できる可能性を示しました。
これは、代謝疾患の予防・改善への新たなアプローチとなり得るだけでなく、臓器移植時の低温保存、外科手術における代謝負荷の軽減、さらには宇宙長期滞在時の省エネルギー戦略としての応用も期待されます。
5. 用語説明
*1 インスリン抵抗性
インスリンが十分に分泌されていても、肝臓や筋肉などの細胞がインスリンの働きに反応せず、血糖を取り込みにくくなる状態。
*2 Qニューロン、QIH
視床下部の神経細胞群「Qニューロン」は、筑波大学の研究グループによって同定された神経回路であり、その活性化により低体温・低代謝状態が人工的に誘導できることが報告されています(Takahashi et al., Nature 2020, PMID: 32528181)。この状態はQIH(Q-neuron induced hypothermia and hypometabolism)と呼ばれ、冬眠様の生理状態を再現するモデルとして用いられています。
*3 褐色脂肪組織
主に体温維持のために熱を産生する脂肪組織。新生児や冬眠動物に多く、エネルギー代謝の調節にも関与する。
研究助成等について
本研究は、文部科学省 科学研究費補助金 学術変革領域研究A 「冬眠生物学2.0」 (23H04943; 榎木亮介)、学術変革領域研究B 「冬眠生物学」 (20H05769; 榎木亮介)、若手研究(24K23255; 李明亮)、基盤研究S(20H05669; 根本知己)、基盤研究A(25H01025; 根本知己)、特別研究員奨励費(22KF0422; 李明亮、23KF0096; 張菁圃)等、日本医療研究開発機構(AMED)脳神経科学統合プログラム(課題名:人工冬眠に向けた低体温-低代謝状態の脳神経機能の作動原理の解明, 先端レーザー光制御が導く脳機能の時空間縦断イメージング技術の創成)(JP24wm0625211; 榎木亮介, JP24wm0625105; 根本知己)、ExCELLS計画研究(榎木亮介)、ExCELLS課題研究(25EXC501、21-205; 榎木亮介)等の支援を受けて実施されました。
論文情報
雑誌名: Nature Communications
論文名: Body temperature regulates glucose metabolism and torpid behavior
著者: Ming-Liang Lee*, Ching-Pu Chang, Chitoku Toda, Tomomi Nemoto, Ryosuke Enoki*
(*責任著者)
DOI: 10.1038/s41467-025-61499-2
お問い合わせ先
(研究内容に関するお問い合わせ)
自然科学研究機構 生命創成探究センター/生理学研究所
准教授 榎木 亮介(Ryosuke Enoki)
(広報に関するお問い合わせ)
自然科学研究機構 生命創成探究センター(ExCELLS)研究力強化戦略室
自然科学研究機構 生理学研究所 研究力強化戦略室
リリース元


自然科学研究機構 生命創成探究センター(ExCELLS)
自然科学研究機構 生理学研究所
4698
 図1. Qニューロンの人工的な活性化は、熱産生を低下させ、熱放散を促進し、体温を室温近くまで大きく低下させる。この低体温状態には、糖尿病に類似した代謝状態が伴う。
図1. Qニューロンの人工的な活性化は、熱産生を低下させ、熱放散を促進し、体温を室温近くまで大きく低下させる。この低体温状態には、糖尿病に類似した代謝状態が伴う。 図2. 環境温度を上昇させることで、Qニューロンにより低体温状態となったマウスの体温が回復し、低代謝状態も元に戻る。この結果は、体温が代謝の調節において重要な要因であることを示唆している。
図2. 環境温度を上昇させることで、Qニューロンにより低体温状態となったマウスの体温が回復し、低代謝状態も元に戻る。この結果は、体温が代謝の調節において重要な要因であることを示唆している。
