【本研究のポイント】
-
ミクログリア*1が、がんの「種」を食べ転移を断つ瞬間を初めて生体内で観察
-
2光子顕微鏡*2と「光」標識で、攻防の現場にいたミクログリアだけを特定・解析
-
ミクログリアの働きを高めることで、脳転移*3を予防できる可能性を提示
研究概要
名古屋大学大学院医学系研究科 分子細胞学の辻 貴宏研究員(当時)(現:米国フレッド・ハッチンソンがん研究センター Postdoctoral Fellow)、和氣 弘明教授(生理学研究所 教授/クロスアポイントメント)らの研究グループは、がん細胞が脳に転移する「最初の瞬間」に脳の免疫細胞・ミクログリアががん細胞を直接“食べて”排除することを生体内の観察に優れた2光子顕微鏡で観察し、明らかにしました。
脳転移は治療が難しく、多くの患者さんの生命を左右します。これまで、別の臓器から飛来したがん細胞の「種」が血流に乗って脳にばら撒(ま)かれた直後、脳の防御を担う“番人”であるミクログリアが、なぜがんの成長を許してしまうのかは謎でした。
本研究では、生きたマウスの脳を2光子顕微鏡で観察し、がん細胞とミクログリアの“攻防戦”をリアルタイムに記録しました。すると、一部のミクログリアはがんを積極的に食べて排除する一方、別のミクログリアは逆にがんの生存や成長を助けることが観察されました。研究チームは、独自に開発した「オプト・オミクス*4」により、がんの「種」の周囲で働くミクログリアだけに光を当てて印を付けて回収し解析しました。単細胞解析や時系列の腫瘍の発現解析などとデータ統合することで、がん細胞が持つ「2224」などの“食べないで”シグナル*5がミクログリアの攻撃をかわす鍵であることを明らかにしました。これらの分子を除去すると、ミクログリアは再び強力にがんの「種」を攻撃し、脳転移が大幅に抑制されます。この成果は、がんが脳に根付く前に「自然免疫の力」で芽を摘むという新しい治療戦略につながります。今後、脳転移を未然に防ぐ医療の実現が期待されます。
なお、本研究は京都大学大学院医学研究科 呼吸器内科学の平井 豊博教授、東京科学大学 総合研究院 難治疾患研究所 計算システム生物学分野の島村 徹平教授、国立がん研究センター研究所 腫瘍免疫研究分野の西川 博嘉分野長(名古屋大学大学院医学系研究科分子細胞免疫学教授、京都大学大学院医学研究科附属がん免疫総合研究センターがん免疫多細胞システム制御部門教授/クロスアポイントメント)との共同研究により行われました。本研究成果は、、2025年12月10日(日本時間12月11日0時)に米国癌学会発行の学術誌『Cancer Research』オンライン版に掲載されました。
|
1. 背景と概要
がん死亡の主因は転移です。なかでも脳転移は治療選択肢が限られ、生活の質と生命予後を大きく損ないます。さらに、脳に大きな腫瘍ができてからの治療はいくつかあるものの、「最初の一粒(=種)」が脳に到着した直後を狙い撃つ方法は、ほとんど確立していません。これは、がんの最初の一粒が非常に小さく、顕微鏡でようやく見つけられる大きさであるため、その発見、単離、解析が非常に難しいことも理由の一つです。
その一方で、脳にはミクログリアという“番人”がいます。脳唯一の免疫細胞であり、細菌や異物を見つけると素早く駆けつけ、食べて処理します。では、別の臓器から血流に乗ってやって来たがんの「種」に対しては、ミクログリアはどのように対応するのか――。この最初の数時間〜数日の攻防は脳の奥で起こるため観察が難しく、長年未解明のままでした。
従来研究は、できあがった転移巣や摘出標本という“静止画”からの推測が中心で、「その場で何が起きたか」「どの細胞ががんと戦うのか」を経時的に直接観察下で追うことができませんでした。この制約はミクログリアに貪食(どんしょく)
*6されたがん細胞は観察できず、生き残ったがん細胞だけが観察される、という観察の偏りを生み、ミクログリアの“貪食して守る側面”が過小評価されやすい状況を招いていました。結果として、ミクログリアやその仲間のマクロファージは「がんを助ける細胞」とみなす研究結果が多く、これがミクログリアを転移予防に生かす戦略づくりのボトルネックになっていました。
研究チームはこの壁を越えるために、1細胞レベルで観察できる2光子顕微鏡を用いて、播種性(はしゅせい)のがん細胞(DTC)
*7を生きたマウスの脳内でとらえる技術を開発しました。そして、DTC周囲のミクログリアが、がん細胞を排除する瞬間をカメラで捉えました(図1)。一方で、番人であるはずのミクログリアが腫瘍の成長を許し、微小な転移を形成する過程も捉えられました。そこで、腫瘍の周囲に存在するミクログリアは疾患特異的な働きをするのではないか、と考えた研究チームは、攻防の現場にいた細胞だけに光で印を付ける方法を、ホログラム技術を応用した「ホログラフィック2光子顕微鏡
*8」を用いて開発し、この「オプト・オミクス」技術によって、今まさにがんと対峙しているミクログリアだけを標識・回収・解析することに成功しました。
これにより、がんの「種」とミクログリアのリアルタイムのやり取りと、その裏で動く分子メカニズムを結びつけて理解する道が開けました。
脳に根を張る前の“最初の瞬間”に、脳の番人の力を最大化して転移の芽を摘む。この発想が実現すれば、将来、脳転移を「起こさない」医療へ近づけると期待されます。
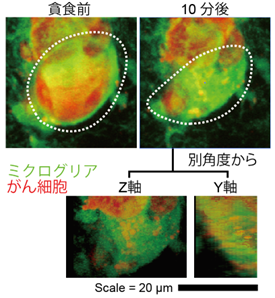
図1 ミクログリアが、生体内でがん細胞を貪食して排除する瞬間
2. 研究成果
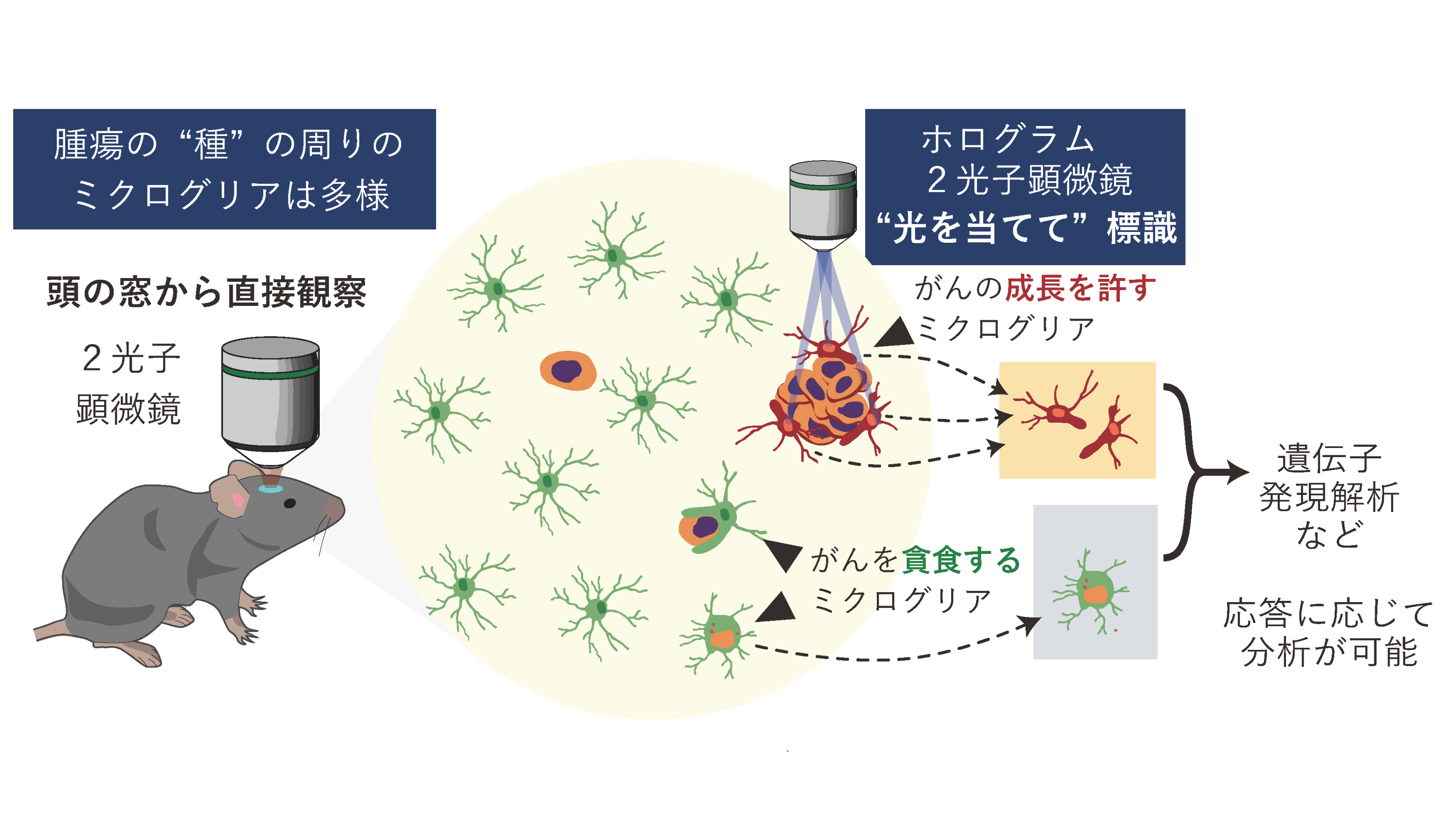
図2 ミクログリアのDTCへ対する多様な応答と光標識による解析
1. 脳転移がおこる“最初の瞬間”の可視化に成功
研究チームは肺がんの脳転移の初期段階にあるモデルマウスを開発しました。このマウスの脳を2光子顕微鏡で観察し、ミクログリアががんの「種」を直接食べて排除する(貪食)決定的な場面を捉えました(図1)。生体内で、ミクログリアが播種性のがん細胞の「貪食の瞬間」を高解像度で撮影した記録はこれまでになく、ミクログリアは貪食を通じてがんと戦う可能性があることを示しました。
2. ミクログリアの“多様性”を発見
これまでの知見では、ミクログリアはがん細胞の成長を助けるという考え方が主流でした。研究チームは1細胞レベルでの生体内での可視化と、「シングルセルRNAシーケンシング
*9」という方法を使って、すべてのミクログリアががん細胞を助けるとは限らず、その一部はがんを食べて脳を守る一方、別の一部はがんの生存・成長を助けることを確認し、脳内のミクログリア応答が一様でないという証拠を、顕微鏡による観察と、細胞の「遺伝子発現」のパターンから示しました(図2)。
3. 「攻防の現場の細胞」に光を当てて解析
研究チームは、さらに、がん細胞の付近のミクログリアだけが主に形を変え、何らかの反応(応答)をすることを見出しました。そこで、この反応したミクログリアだけを解析するために、光を当てると色が切り替わる蛍光タンパク質(PSmOrange2
*10)を組み込み、ミクログリアが橙色に蛍光するマウスを作りました。このPSmOrange2は特定の波長(930nm)の光を当てると、オレンジ色から近赤外色に変わる“色替えスタンプ”のように働きます。これを利用し、2光子顕微鏡と2光子ホログラム(光を微小領域に集中的に当てる技術)で数マイクロメートル単位の精度で照射することでがん細胞のすぐ近くに集まったミクログリア“だけ”に光を当てて、現場にいた細胞を見分けられるようにしました(図2)。
色が切り替わったミクログリアは、フローサイトメトリー
*11を使って選び出して回収し、その遺伝子の働き(発現)をSMART-seq法というシングルセル・トランスクリプトーム解析で詳しく遺伝子発現を解析しました(図2)。さらに、得られたデータをシングルセル・トランスクリプトーム
*12解析と数理解析に重ね合わせることで、腫瘍を「食べる」ミクログリアに関わる分子の経路を特定しました。これにより、“どの細胞が、どの場面で、どんな仕組みで”がんに対処しているのかを、現場の証拠と分子レベルの情報で結びつけて示すことができました。
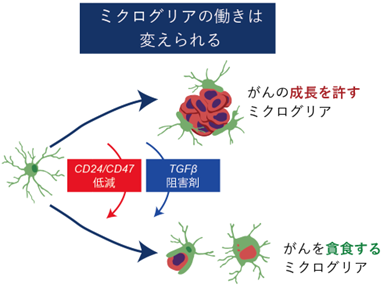
図3:ミクログリアの、がん貪食を引き出す鍵
4. ミクログリアのがん貪食を引き出す鍵を特定
研究チームはがん細胞の種が播種してから転移を形成するまでの間に、どのようなたんぱく質を時系列で発現するかを調査し、がん細胞表面のCD24とCD47(“食べないで”シグナル)が、ミクログリアからの攻撃を回避する鍵であることを解明しました(図3)。これらを弱める/除くと、ミクログリアの攻撃力が再起動し、脳転移が大きく抑制されました。
5. 臨床につながる手がかり
ヒト検体でもCD24やCD47の発現を確認し、治療標的や診断マーカー候補としての可能性が示されました。
3. 今後の展開
今後研究チームは、がんが脳に根付く前の初期段階でミクログリアの力を最大化し、“転移の芽を摘む”予防的治療の実装を目指します。現時点においてCD47の分子標的薬は存在しますが、CD24を抑制する治療法は存在しません。標的分子に対する阻害薬・抗体薬の最適化と、免疫療法や既存薬との併用戦略を検討します。併せて、どの患者さんが恩恵を受けやすいかを見極める予測バイオマーカーの確立に取り組み、個別化医療へつなげます。さらに、今回の枠組み(リアルタイム観察+オプト・オミクス)を他がん種・他臓器へ展開し、汎用的な“転移初期制御”プラットフォームの確立を進めるだけでなく、他の神経疾患におけるミクログリアの役割解明にもつなげていくことを計画しています。
4. 支援・謝辞
本研究は、これらの事業の支援のもとで行われたものです。
-
科学技術振興機構(JST) 戦略的創造研究推進事業 (CREST) 「ホログラム光刺激による神経回路再編の人為的創出」(JPMJCR1755)
-
科学技術振興機構(JST) 戦略的創造研究推進事業 (CREST) 「神経-免疫連関による感覚認知システムの統合的理解」(JPMJCR22P6)
-
科学技術振興機構(JST) ムーンショット型研究開発事業 「身体的能力と知覚能力の拡張による身体の制約からの解放」(JPMJMS2012)
-
科学技術振興機構(JST) 戦略的創造研究推進事業 ACT-X 生命現象と機能性物質「オプト・オミクスが明らかにする脳内微小環境と癌細胞の分子基盤」(JPMJAX2229)
-
日本医療研究開発機構(AMED) 革新的先端研究開発支援事業 (AMED-CREST) 「糖鎖による神経回路形成制御とその破綻:精神疾患の病態解明」(JP23gm1410011)
-
日本医療研究開発機構(AMED) ムーンショット型研究開発事業 「グリア病態からセノインフラメーションへ発展する概念に基づく認知症発症機序の早期検出と制御」(JP24zf0127012)
-
日本医療研究開発機構(AMED) ムーンショット型研究開発事業 「認知症克服に向けた脳のレジリエンスを支えるリザバー機能とその増強法の開発研究」(JP24zf0127010)
-
日本医療研究開発機構(AMED) 医療分野国際科学技術共同研究開発推進事業 「グリア細胞の生理機構解明とその遷移による中枢神経疾患に対する創薬戦略の国際共同開発」(JP23jf0126004)
-
日本医療研究開発機構(AMED)次世代がん医療創生研究事業・次世代がん加速化研究事業 領域E 「脳内微小環境と癌細胞の相互作用を解明する異分野融合的解析法」(21cm0106587h0001)
-
内閣府 研究開発とSociety5.0との橋渡しプログラム 「多元素活用を基盤とした生体イメージング技術革新」(BRIDGE)
-
日本学術振興会(JSPS) 科学研究費助成事業 学術変革領域研究(A) 「全身臓器の生理的・病理的免疫状態遷移の脳による検出機構」(20H05899)
-
日本学術振興会(JSPS) 科学研究費助成事業 国際共同研究加速基金(国際共同研究強化(B)) 「感覚モダリティ理解のためのミクログリア・シナプス接触の多角的解析」(20KK0170)
-
日本学術振興会(JSPS) 科学研究費助成事業 基盤研究(B) 「ミクログリアによる高次脳機能維持機構とその破綻」(18H02598)
-
日本学術振興会(JSPS) 科学研究費助成事業 「ミクログリアによる感覚モダリティーの制御と精神病態への寄与」(21H02662)
-
日本学術振興会(JSPS) 科学研究費助成事業 「量子ドット温度イメージングセンサーによる生体脳温度計測の実現と脳疾患治療への応用」(JP25H01217)
-
日本学術振興会(JSPS)特別研究員(PD)「転移性脳腫瘍の予防治療開発を目指した、生体内イメージング系の構築と解析」 (21J01531)
-
日本学術振興会(JSPS) 科研費 若手研究「脳内における肺癌細胞の排除を規定するメカニズムの可視化と同定」 (21K16140)
-
かなえ医薬振興財団「転移性脳腫瘍発生の「場」の時空間的解析と治療開発」
-
武田医薬振興財団 医学系研究助成 「脳内免疫応答に着目した転移性脳腫瘍をターゲットとした治療開発」
【用語説明】
*1)ミクログリア
脳の中に常駐する免疫細胞。病原体や壊れた細胞を見つけて“食べて片づける”役割があります。腫瘍の初期段階でも、がん細胞を取り囲んで排除したり、反対に助ける働きの両方を持ちうることが今回の研究で明らかになりました。
*2)2光子顕微鏡
生体の深い場所(脳の奥)も高解像度で観察できる特殊な顕微鏡。今回、マウスの脳内でミクログリアがDTCを“食べる瞬間”の観察に使いました。
*3)脳転移
体の別の臓器で発生したがん(肺がんなど)が血流などに乗って脳へ拡がり、脳で増えること。治療選択肢が限られ、患者さんの予後に大きく影響します。
*4)オプト・オミクス
「光学(オプト)」で現場の細胞に印をつけてから、その細胞の遺伝子発現(オミクス)を解析する手法として著者たちが命名しました。今回、腫瘍のすぐ近くにいたミクログリアだけに光を当てて解析しました。
*5)“食べないで”シグナル
がん細胞の表面にある「食べられないようにする合図(“Don’t-eat-me” signals)」。ミクログリア(やマクロファージ)による貪食を抑え、がんの生存に有利に働くことがあります。本研究ではCD24とCD47がDTCで上昇し、機能的に重要であることを示しました。
*6)貪食(どんしょく)
免疫細胞が異物や傷んだ細胞、がん細胞などを包み込んで分解・除去する働き。
今回、ミクログリアがDTCを直接“食べる”様子を生体内で確認しました。
*7)播種性のがん細胞(DTC: disseminated tumor cell)
原発巣から離れて血流などで運ばれ、脳など別の臓器へ“飛んできた”単離のがん細胞。将来の転移の“種”に相当します。
*8)ホログラフィック2光子顕微鏡
レーザーの焦点形状をホログラムで自在に作り、自由に光の照射パターンをデザインできる2光子顕微鏡です。1細胞を正確に照射できる2光子顕微鏡。標的細胞だけを“光でマーキング”するのに用いました。
*9)シングルセルRNAシーケンシング
1個1個の細胞ごとの遺伝子発現を網羅的に測る解析法。ミクログリアの多様性(がんを“攻める”群と“助ける”群など)を解析するのに使いました。可視化には得られた高次元データを要約する新しい特徴量を抽出する手法であるUMAP(Uniform Manifold Approximation and Projection )などを用いています。
*10)PSmOrange2
特定の波長の光を当てると蛍光色が変わるタンパク質(PSmOrange2)をミクログリアに発現させ、照射した細胞だけの色を切り替えて識別・回収しました。
*11) フローサイトメトリー
蛍光の有無などで細胞を1個ずつ仕分け・回収する装置/手法。“光で印を付けた”ミクログリアだけを回収するのに使いました。
*12)トランスクリプトーム
細胞の中で今どの遺伝子がどれくらい働いているか(RNA)の全体像。細胞の“状態”や“役割”の違いを知る手がかりになります。
論文情報
雑誌名:
Cancer Research
論文タイトル:Microglia Display Heterogeneous Initial Responses to Disseminated Tumor Cells
著者:辻貴宏, 廣瀬遥香, 杉山大介, 進藤麻理子, Rahadian Yudo Hartantyo, 齋藤祐太朗, 立松律弥子, 杉尾翔太, 三宝誠, 平林真澄, 小嶋 泰弘, 小関準, 細谷和貴, 吉田寛, 大木元達也, 安田有斗, 橋本健太郎, 味水瞳, 阪森優一, 吉田博徳, 佐野徳隆, 丹治正大, 伊藤寛朗, 寺田和弘, 濱路政嗣, 毛受暁史, 小西博之, 熊谷尚悟, Cyrus Ghajar, 加藤大輔, 伊達洋至, 吉澤明彦, 荒川芳輝, 小笹裕晃, Andrew Moorhouse, 島村徹平, 西川博嘉, 平井豊博, 和氣弘明
DOI:10.1158/0008-5472.CAN-25-3425
お問い合わせ先
【研究者連絡先】
名古屋大学大学院医学系研究科 分子細胞学
生理学研究所 多細胞回路動態研究部門
教授 和氣 弘明(わけ ひろあき)
東京科学大学 総合研究院
難治疾患研究所 バイオデータ科学研究部門 計算システム生物学分野
教授 島村 徹平(しまむら てっぺい)
【報道連絡先】
名古屋大学医学部・医学系研究科 総務課総務係
科学技術振興機構 広報課
東京科学大学 総務企画部 広報課 総務・メディアグループ
生理学研究所 研究力強化推進室
【JST事業に関すること】
科学技術振興機構 戦略研究推進部 先進融合研究グループ
原田 千夏子(はらだ ちかこ)
リリース元




国立大学法人東海国立大学機構名古屋大学
国立研究開発法人科学技術振興機構(JST)
国立大学法人東京科学大学
大学共同利用機関法人自然科学研究機構生理学研究所
5251





