片桐 展子(東京女子医科大学・総合研究所・研究部)
片桐 康雄(東京女子医科大学・看護学部・基礎科学系)
有井 達夫
光受容細胞内の光小胞 (photic vesicle) は径80nmのclear vesicles で小胞体 (ER) の特殊形の一つである。軟体動物・腹足類の感杆型光受容細胞内に多量に含まれ,感光性色素タンパク質レチノクロムの局在部位として知られる。軟体動物のロドプシン-レチノクロム系において,レチノクロムは視物質ロドプシンの再生に発色団11-cisの供給源となる。光小胞は加温オスミウム染色で黒染し高コントラストとなるので,準薄切切片を超高圧で電顕観察できる。光小胞の形成過程を知るために,イソアワモチ類(海産の腹足類)幼動物を用い,未成熟な光受容細胞内における光小胞とERやゴルジ層板との関連について超高圧電顕トモグラフィー解析を試みた。
【方法】連続切片(0.3μm厚,加温オスミウム染色処理,エポン樹脂包埋)を1,500~10,000倍で観察し,撮影視野内に光受容細胞(光小胞と周辺の小器官)を選択した。トモグラフィーによる解析のため,+60°~-60°まで,2℃間隔で,15,000,20,000および30,000倍の3シリーズで超高圧電顕により撮影した。予め撮影部位を,+60°~ -60°まで傾斜させてX, Y, Z軸を合わせておき,+60°から-60°へ一方向に角度を変えた。前の像の輪郭をモニター上に描き,角度を変えた際の像を前の像に重なるように微小な位置合わせを行って撮影した。フィルムを現像し,スキャナーで取り込み,データをデジタル化した。デジタル化した一連のデータの位置合わせは画像解析ソフトDeltaViewerを用いた。
【結果と考察】各視野は焦点を変えて 2 - 3 枚撮影し,1シリーズは約200枚になった。このため,観察中のフィルム交換(3 - 4回)やフイルム現像に伴って,原フィルムに明暗,コントラストなどのムラを生じ,デジタル化後にphotoshopによる調整が必要であった。また,フィルムのデジタル化はスキャナーによる取り込みの条件などによってデータ量が大きくなった。解析部位を特定して画像の一部を切り取って適格な画像サイズの一連のデータとした。位置合わせには,今回用いた試料がコロイドなどのマーカーをつけていないため,位置合わせの機能(容易で正確)に優れているDeltaViewerを用いた。位置合わせができたデータについて,トモグラフィー解析ソフトIMODを用いて三次元解析を行った(図)。
日高 聰(藤田保健衛生大学医学部生理学教室)
Gap junctions represent an important means of direct cell-to-cell communication between coupled cells, which are aggregates of intercellular membrane channels formed by a family of connexins. Gap junctions are the major structural elements of electrical synapses in the connected cell population. Study of electrical synapses needs comprehensive evidence showing functional significance by simultaneous dual patch-clamp recordings between neighboring cells of certain neuronal type and structural identification of gap junctions between the examined cells.
Electrical synapses in networks of inhibitory interneurons have been extensively studied. In contrast, studies of gap junctions between excitatory neurons in major neuronal pathways are considered to be less copious and in fact might be relatively rare. In retinal ganglion cells, the occurrence of electrical synapses between neighboring cells has been proposed by electrophysiological recordings of distributed spikes. For a specific cell type, α-type ganglion cells (α-GCs), synchronous spike activity has been described in the cell population. In the present study, electrical synapses between α-GCs were detected using combined techniques of dual recordings, high-voltage electron microscopy and connexin immunocytochemistry in rat retina.
Measurement of tracer coupling between α-GCs resulted in preferentially homologous occurrence among cells of the same morphological type. In high-voltage electron microscopic analysis of 5-μm-thick sections, direct dendrodendritic gap junctions (average size 0.86 μm long) were present in contact sites between tracer-coupled α-GCs. In dual recordings from pairs of neighboring α-GCs, bidirectional electrical synapses and precise temporal synchronization of spike activity were detected in the cell pairs. Connexin36 immunoreactivity was undertaken in Lucifer yellow-labeled cell pairs after patch-clamp recordings. Confocal laser-scanning imaging demonstrated that connexin36 is located at dendritic crossings between electrically coupled cells. These results give conclusive evidence for electrical synapses via dendrodendritic gap junctions in α-GCs of the same physiological type.
文献
Hidaka, S, Akahori, Y, & Kurosawa, Y (2004) Dendrodendritic electrical synapses between mammalian retinal ganglion cells. Journal of Neuroscience, Vol 24(No 46): pp 10553 - 10567.

Figure 1.
A, A confocal projected image demonstrating dendritic interconnections (arrows) in Lucifer Yellow labeling of a pair of electrically coupled α-GCs. This cell pair showed bi-directional electrical synapses by simultaneous dual patch-clamp recordings.
B, Electron micrograph showing the direct junctional contact between Neurobiotin-coupled neighboring α-GCs. The occurrence of dendrodendritic gap junction (arrows) was revealed by high-voltage electron microscopy at 1,000 kV in a tangential 5-μm-thick section.
【追加情報】(調査月2007年8月、記入月2008年6月)
発表論文
関係論文
長浜真人(三重大学医学部解剖学第二講座)
有井達夫
消化管壁内神経叢内には多くのニューロンが含まれておりその数は脊髄に含まれるニューロン数に相当する。これらの壁内ニューロンは現在,種々の神経マーカーにより多数のサブタイプに分類されているが,これらのニューロンは,長い軸索様突起と短い樹状突起の性状・数などにより,形態学的には主に3 - 4種類に分類されている。PACAPやVIPを含有する抑制性ニューロンは一本の長い軸索様突起と細胞体周囲の複数の短い樹状突起を持つDogielのType Iと言われる形態を示すものが多く認められる。既に私共の報告でこれらの樹状突起様突起には多数のシナプス入力を確かめているが,樹状突起の微細な三次元構築に関する解析はなかった。今回,我々は免疫染色(ABC法とにニッケル・コバルト増感法)を施したこれらの神経ペプチド含有ニューロンをプラスチック包埋し,3-5ミクロン切片を作製して超高圧電子顕微鏡にて観察した。ニューロンの細胞体周囲に微細な突起を立体的に観察することができた。細胞周囲のごく短い樹状突起と,その遠位部に微細な突起を複数有する比較的長めの樹状突起を認めた(図)。今後,標識細胞のコントラストをより高くし,樹状突起の形態的な異同,分類,解析を計画している。
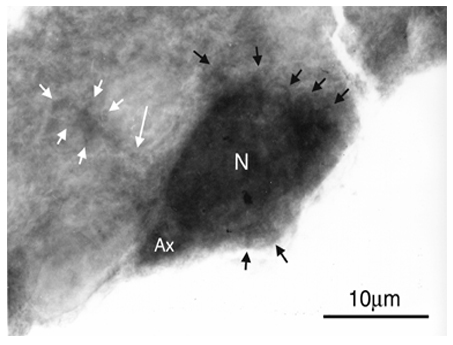
筋層間神経叢辺縁部に位置するDogiel - I型のPACAP含有ニューロン(N)。PACAP含有ニューロンには細胞体周囲に複数の短小樹状突起(黒矢印)とやや長めの樹状突起(長白矢印)が一本認められる。この長めの樹状突起の遠位部には複数の小突起(短白矢印)が認められる。Axは軸索突起の細胞体近位部。
【追加情報】(調査月2007年8月、記入月2008年6月)
関係論文
野田 亨(藍野大学医療保健学部理学療法学科)
出生直後のラット中枢神経組織には新たに神経細胞を生み出すことのできる神経幹細胞が存在すると言われている。この細胞は神経細胞のみならず,中枢神経組織に見られるグリア細胞,すなわち,オリゴデンドロサイト(希突起膠細胞),アストロサイト(星状膠細胞),ミクログリア(小膠細胞)などにも分化する能力を有する。この点に着目して,神経幹細胞からそれぞれの細胞の分化過程を形態学的に捉え,それぞれの細胞の三次元構造上の変化をも超高圧電顕で観察しようとした。
生後1日ラットの大脳側脳室直下 (SVZ) から採取した組織をトリプシン処理などで個々の細胞に分離し,EGF,bFGF,heparan sulfate存在下で培養した。細胞は培養数日後に神経幹細胞塊 (neurosphere) を形成し始めた。この細胞塊を培養開始後,1週間,2週間,4週間目に4%フォルムアルデヒドを含む固定液で固定し,OCT コンパウンドメディウムを浸透,凍結させ,それぞれの時期のneurosphereの凍結切片をクリオスタットで作製した。それらの切片に対して,まず神経細胞,オリゴデンドロサイト,アストロサイトなどの標識蛋白に対する抗体を用いて蛍光抗体法でそれぞれの蛋白の発現を検索した。
神経前駆細胞に見られる中間径フィラメントであるネスティン,神経細胞に発現する微小管のチューブリンtype IIIなどの蛋白は培養開始後1週ではやや不明瞭な発現を示したが,3週で最も明瞭な局在を示した。またアストロサイトに発現する中間径フィラメントであるGFAPは2週目以降のneurosphereに比較的安定して観察されたが,オリゴデンドロサイトを標識するO4蛋白の発現は不明瞭で安定した結果が得られなかった。次にこれらの試料について超高圧電顕による観察を行うために同じ一次抗体を用いて,酵素抗体法により,種々の細胞の電子密度を上げる試みをしたが,必ずしもそれらの細胞の三次元構造についての明瞭な所見を得ることができなかった。この理由にはそれぞれのマーカーとされる蛋白が最も強く発現するタイミングを捉えていなかったこと,培養条件がneurosphereの培養,分化に適していなかった可能性も考えられ,方法論的に改善する余地があると思われ,さらに研究を継続する必要がある。
小澤一史(京都府立医科大学・大学院医学研究科生体構造科学部門)
副腎皮質から分泌されるコルチコステロイドは脂溶性のホルモンであり,その化学的性状から容易に血液脳関門を通過して,受容体を介して神経系の細胞に直接作用する。脳内におけるコルチコステロイド受容体にはミネラルコルチコイド受容体 (mineralocorticoid receptor, MR)とグルココルチコイド受容体 (glucocorticoid receptor, GR) の2種類からなることが知られている。これらの2つの受容体は特に脳の海馬領域において豊富に分布していることが知られており,血中のコルチコステロンの変動に伴って,両者の受容体の機能調節が行われる。
血中コルチコステロン濃度の変化によって海馬の錐体細胞や顆粒細胞の構造変化が生じることが報告されているが,細胞の樹状突起,ことに棘 (spine) の形態変化に関する観察は,通常の透過型電子顕微鏡による二次元的観察では,情報量としての限界があり,このような場合には超高圧電子顕微鏡を用いた三次元的解析が効果を示す。そこで,我々はsham手術群(コントロール)と副腎を摘出し,血中コルチコステロンが減少あるいは消失している群(副腎摘出<ADX>群)を作成し,海馬錐体細胞CA1,CA3における尖側及び基底側の樹状突起棘の変化について超高圧電子顕微鏡を用いたステレオ観察によって三次元的な解析を続けている。その結果,CA1領域(GRが発現)の錐体細胞の樹状突起の棘は,コントロール群では密に存在し,headとtailを有する典型的な形状を構築するのに対して,ADX群では,密度の低下や形状の変化が認められ,シナプス形成の変化による神経機能反応の変化が生じている可能性が強く示唆された。この変化はコルチコステロンの補充によって回復する。一方,GRが発現していない,CA3領域の神経細胞ではこのような変化は認められなかった。これらの現象は,通常の電子顕微鏡観察,共焦点レーザー走査型顕微鏡,免疫組織化学的検索によって,ある程度観察可能であるが,超高圧電子顕微鏡による観察によって,明快にかつ定量的解析も加えて客観的に示すことが出来,大きな効果を示すことが出来る。これらの観察から海馬の神経細胞は血中コルチコステロン濃度の変動に部位特異的に反応し,GR受容体を介して入力様式がホルモン環境によって修飾されることが強く示唆された。
遠藤 泰久・西田 倫希(京都工芸繊維大学)
有井 達夫
神経栄養因子のひとつである神経成長因子(NGF) は神経細胞における突起伸長,シナプス形成,生存維持などに関与する分化促進因子であり,その作用は細胞膜に存在する受容体TrkAと高親和的に結合することによって発現する。最近,受容体TrkAがカベオラと呼ばれる細胞膜陥入部位に局在することを示唆する報告がなされたが,微細構造については不明な点があった。微細構造のレベルでの受容体TrkAの局在を明確にするため,神経系培養細胞PC12細胞を用い,免疫細胞化学的に超高圧電子顕微鏡により3次元的立体構造の検討を継続して実施している。その過程でカベオラではなく,クラスリン被覆の飲み込み小胞との関連を明らかにするため,クラスリン抗体を使った免疫電顕により3次元構造解析を行った。
ホルムバール支持膜を張った金メッシュを70% エタノールで滅菌後,コラーゲンコートを施し,PC12細胞をDMEM培地にNGF(最終濃度50ng/ml)を添加し4日間培養した。細胞をパラフォルムアルデヒドで固定後,クラスリンの特異抗体を用い免疫染色を行い,ABC-HRP法によりDAB-硫酸ニッケルで発色し,臨界点乾燥した。超高圧電子顕微鏡(H-1250M 加速電圧1,000kV)により,試料の同一視野を-60度から+60度まで2度刻みの傾斜連続写真を撮影し,IMODにより3次元画像解析を行った。
PC12細胞の細胞膜上のクラスリン免疫反応は,球形の小胞および楕円形のエンドソームに観察された。小胞におけるクラスリン免疫反応は,ほぼ全面に見られるものだけでなく,球体の一部に反応がないものもみられた。後者は細胞膜に開口しているcoated pitsに相当するか,飲み込み小胞の表面のクラスリン被覆が均一でない可能性が考えられる。
小胞は集団をなしてみられることが多く,一部はエンドソームと思われる楕円形の構造の周辺に集積しており,密着しているものもしばしば観察された。これは飲み込み小胞がエンドソームに融合する瞬間をとらえているものと考えられる。
以上の結果は,これまで観察してきたTrkAの免疫反応に非常に類似しており,神経細胞における神経栄養因子受容体がリガンドと結合した後,細胞内に飲み込まれる過程に,クラスリンが関与していることを示唆するものと考えられる。

A. PC12細胞のクラスリン免疫反応。金メッシュ上で培養した細胞を免疫染色し,臨界点乾燥後,超高圧電顕で撮影した。arrow, endosome. scale, 2μm
B. コンピュータトモグラフィで3次元構築したクラスリン免疫陽性反応の構造。arrow, endosome. scale, 2μm
C. 図Bの矩形部の拡大。陽性反応を示す小胞ごとに色分けして示す。arrow, endosome. scale, 1μm
【追加情報】(調査月2007年8月、記入月2008年6月)
発表論文
樋田一徳(徳島大学大学院ヘルスバイオサイエンス研究部)
嗅覚の一次中枢・嗅球の糸球体は末梢(鼻粘膜)からの入力である嗅受容細胞から中枢への出力の投射ニューロンへシナプス結合する場であるが,両者の間には種々の局所ニューロンが介在し,匂い識別等の糸球体機能を調節していると考えられている。今年度は,我々がこれまで嗅受容細胞と投射ニューロンとの間に特徴的なシナプス結合を形成する事を明らかにしてきた各種介在ニューロンのうち,嗅受容細胞から高頻度にシナプス結合を受け異なる投射ニューロン樹状突起間に連続シナプスを形成するTyrosine Hydroxylase (TH) 各免疫陽性ニューロンについて焦点を絞り,超高圧電子顕微鏡により形態解析を行なった。
共焦点レーザー顕微鏡による解析が困難なTHニューロンは,重金属増感DAB法及び金粒子増感法によって超高圧電子顕微鏡下で観察に適した像が得られ,糸球体内に広く突起を分布しているのが特徴である(生理学研究所年報第23巻152-153頁,業績リスト-論文・学会)。今年度,光顕トルイジンブルー染色の準超薄連続切片の解析により,THニューロンは糸球体内に存在する嗅受容細胞終末による小分画構造を横断していることが示唆された。この構造的特徴は更に超高圧電子顕微鏡によって確かめられ,抗体の浸透度の限りはあるものの(~10μm),観察可能空間において,1~2μm径と0.1~0.5μm径の大小の太さの突起の多くは共に糸球体を横断していることが分かった(付ステレオ図)。
嗅受容細胞と投射ニューロン間の相互シナプス結合は,匂い特異的に投射する嗅受容細胞の糸球体内の小区画的な存在様式に対応して存在していると考えられるが,THニューロンはこれらの小区画に,特徴的な位置関係にあることが超高圧電子顕微鏡によって示された。同定されたシナプス結合のタイプからも匂い識別に関する糸球体機能に重要な役割を演じている事が推測される。
厚い試料を高解像度で立体解析が可能な超高圧電子顕微鏡は,ニューロンの複雑な樹状突起網やグリアの突起構造を解析するには極めて有用であり,今後は,各種ニューロンの受容体の局在や関連するグリアを含めたより詳細な三次元構造解析を行なう予定である。
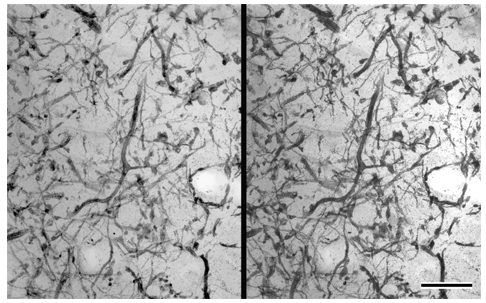
ラット嗅球糸球体THニューロンの樹状突起網のステレオ像(±8°)Bar = 10μm
小曽戸陽一 (ドイツ・マックスプランク研究所・Molecular Cell Biology and Genetics)
樋田一徳,清蔭恵美 (徳島大学大学院・神経情報医学部門・情報統合医学講座・形態情報医学分野)
有井達夫
Recent studies on the generation of neurons from their precursor cells (=neuroepithelial cell) in embryonic mammalian brain have revealed that these cells do not completely round up in mitosis, but retain a very thin basal process throughout cytokinesis. Using a mitosis-specific marker, we have also observed that the basal process of neuroepithelial cells dividing at the apical surface of the ventricle zone is maintained during mitosis, although it becomes quite thin (less than 0.5 μm in diameter) and long (more than 100 μm) extending to the basal lamina. We hypothesize that despite its thread-like shape, the basal process is actually divided during cell division.
We have established a method to visualize the ultrafine structure of the basal process. Since the basal process is too thin to obtain spatial information by light microscopy, and too long to be followed its entire length by conventional electron microscopy, we have used High-Voltage Electron Microscopy (H-1250M, NIPS), which enables us to observe thicker sections (up to 5 μm), combined with preembed antibody-DAB staining or Golgi impregnation method. Thin processes have been observed extending from the mitotic cell body. Our results raise the possibility that the basal process of neuroepithelial cells may be divided during cytokinesis.
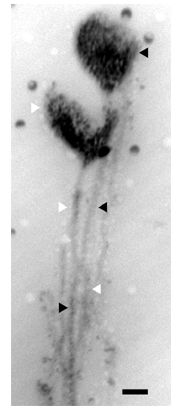
Fig1.
Basal process of mammalian neuroepithelial cell stained by Golgi impregnation. Note that two bulge structures (indicated by black or white arrowhead) are connected to the cell body (below the frame of the image). Bar=0.5 μm
山田直子,M.H.Ellisman(カリフォルニア大学,サンディエゴ校)
濱 清(自然科学研究機構生理学研究所)
本研究は,小脳糸球の複合体である神経顆粒細胞樹状突起終末を超高圧電子顕微鏡 (UHVEM) で観察しコンピュータによる解析を行ったものである。
小脳における巨大シナプス複合体である小脳糸球(すなわち神経顆粒細胞樹状突起,苔状繊維終末,星状グリア細胞突起,ゴルジ細胞及び神経突起等)の機能が全体機能の中でどの様に作用しているかを理解する事を目的として3次元構築を試みた。小脳糸球の大きさは100~300 μm3であり,構成する複合体各々のサイズはほぼ0.05~10 μmである。この巨大シナプス複合体をUHVEMのトモグラフィー観察法を用いて立体的構造を構築する事は糸球状シナプス結合を解明する上で有効な方法である。小脳糸球に豊富に含まれるシナプスの位置やサイズを立体的に再現する事は脳機能のシミュレーションに有効である。
3次元トモグラフィー観察法は,電子顕微鏡 (EM) による微細な構造情報と光学顕微鏡 (LM) 観察による動的な形態や物質情報の理解を繋ぐ大切な役割を果たすと考えられる。UHVEM観察の3次元計測では,LMでの2次元計測の実長の約1.5倍があり,UHVEM観察の微細構造ではZ軸方向が高精度に観察された。
今回ラット神経顆粒細胞樹状突起の巨大で複雑に立体構成された全体像を観察する事が出来た。図1には樹状突起終末の小脳糸球のステレオ立体UHVEM像を示す。図2には図1を3次元トモグラフィー観察する事によって得られたデータをコンピュータ処理し立体構築した3D立体像を示す。厚切り切片 (10 μm~6 μm) のUHVEMトモグラフィー観察は,薄切り切片 (70~100nm) の連続切片から得られる3次元構築像に比べ,位置あわせのずれが無い事と物理的な物の欠損がない事から再現性が優れている。ステレオ立体像観察および3次元トモグラフィー観察によって得られた立体構築像は,複雑な構造を立体的に観察するのに有効であった。
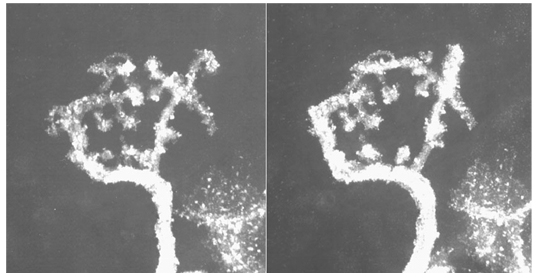
図1. Stereopare of terminal granule cell dendrite viewed with UHVEM
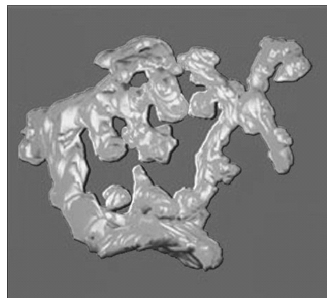
図2. 3D reconstruction image of cerebellar glomerulus
InSun Kim (Keimyung University)
Sung-Sik Han (Korea University)
Image processing by UHVEM and electron tomography has offered major contributions to research areas of both cellular and subcellular levels. Furthermore, such advancements have enabled improved analysis of 3-dimensional cellular structures. In the present study, we attempted to reconstruct the 3-dimensional plastid inclusion body which differentiates during CAM metabolism, using UHVEM from the National Institute for Physiological Sciences (NIPS) in Okazaki, Japan. The spatial relationship which forms between tubular elements and the thylakoidal membrane and/or starch grains have been investigated within the plastid inclusion bodies in CAM-performing Sedum rotundifolium. After fixation of immature mesophyll tissues through a high pressure freezing (HPF) technique and chemical processing, the specimens were cut into serial sections of ultra-thin (60-90nm) and semi-thick (0.15-1.0μm) sections, double stained, and carbon coated. They were examined primarily with the TEM, and tilted every two degrees from +60° to -60° to obtain 2-dimensional images with UHVEM. Diffraction patterns were attained and digital image processing was performed on the elements of the lattice substructure within the inclusion bodies using tilting, tomography, IMOD, and finally UHVEM, to generate and reconstruct the 3-dimensional images on the cellular level.
The crystalline inclusion bodies were found to occur only in early development of mesophyll chloroplasts. The inclusion bodies were not membrane-bounded structures, but varied in shape and size even within the same chloroplast, if more than one inclusion were developed. They always occurred in the stroma and closely associated with thylakoids and starch grains. They consisted of tubular elements, ranging very small to large up to more than 10,000 elements. They exhibited a hexagonal arrangement of the six substructures with approximately 17.9-18.6nm periodicity distance between elements. They but usually were in close association with them. The inclusion bodies of the epidermal chloroplasts will be the subject of a following invest for comparison, since the latter appeared differ in structure and development.

Fig 1. A, Original TEM Image, B, Fourier transformed Image (FTI), scattering Pattern, C. Inverse FFT (fast Fourier transformed) Image.
菅井尚則(福島学院大学短期大学部食物栄養科,福島県立医科大学)
矢橋あつ子(福島県立医科大学)
有井達夫
胃壁細胞は細胞内細管,細管小胞という特徴的な構造を持つ。特に細管小胞の形態像をめぐり,多くの研究者によりさまざまな形態像が報告されている。われわれは,溶媒の浸透圧が290mOsM以上の固定液の逆行性灌流法と言う細管小胞の安定した形態像が得られる方法を明らかにした。この固定法によるラット胃壁細胞の観察結果は,従来の報告通り,細管と小胞の混合した電顕像を示したが,これらの小胞は細管の横断面を示している可能性も考えられた。そこで,細管小胞について,連続切片の通常電子顕微鏡による観察と厚切り切片の超高圧電子顕微鏡による観察を行った。
【材料と方法】Wistar系ラット(雄,8から10週齢)を絶食させ,下に示す方法で固定した。
0.05Mカコジレート緩衝液に蔗糖を加えて,浸透圧計(アドバンス社製)で計測し,3%グルタールアルデヒド固定液の溶媒が300mOsM以上になるよう調整した。背側大動脈を横隔膜下で結紮,腎動脈より遠位の背側大動脈から逆行性に灌流固定を行った。オスミウム後固定,ウラニール液によるブロック染色を行い,脱水,エポンに包埋。80nmの連続切片を作成し通常の電子顕微鏡(100kV,日本電子,1200EX)で観察した。また,0.5μmと1μmの切片を撮影角度を変えながら超高圧電子顕微鏡(1,000kV,日立,H-1250M)の観察を行い,立体視を試みた。
【結果と考察】連続切片による観察では,小胞が切片の4から5枚にわたる連続した像として観察された。また,超高圧電子顕微鏡を用いた立体視では,枝分かれのほとんど認められない細長く伸びる細管が見られ,小胞は見られなかった。これらの結果は,細管と小胞の混合という従来の細管小胞像に疑義を示し,細管小胞は単純な細管で形成されているとの結論を与える。いろいろな細管小胞像がこれまでに提示されてきたが,単純な細管という細管小胞像こそ,壁細胞における細管小胞の動態,特に細管小胞のリクルート・リサイクル説をもっとも良く説明し得るものと考えられる。
文献
Naonori Sugai, Susumu Ito, Atsushi Ichikawa, and Misao Ichikawa: J. Electon. Miceosc. 34, 113-122,1985
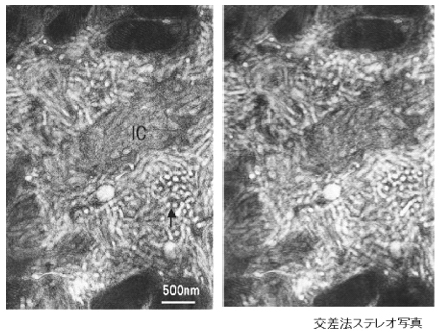
図1.壁細胞の交差法ステレオ写真(±8度):絶食ラットの胃壁細胞。細管小胞が細胞を満たしている。立体視すると,2次元的に小胞と観察された構造も細管であることが明らかである。細管と小胞の混じた構造として細管小胞の名称が与えられたが,細管小胞は単純な細管よりなる構造で,細管あるいは小管と呼ぶのがより真実を伝えると考えられる。
Kea Joo Lee, Hyun Kim, Im Joo Rhyu (Korea University)
Tatsuo Arii, Keiji Imoto (NIPS)
Dendritic spines are major postsynaptic sites that transmit most excitatory inputs in a mammalian CNS. The density, size, and shape of dendritic spines change in response to various physiological or pathological states. To investigate the motor learning-induced structural changes of dendritic spines in the Purkinje cells of rat cerebellum, morphological analyses were conducted from the rats trained in acrobatic condition demanding a significant motor coordination and balance (AC) using HVEM (H-1250M, NIPS, Okazaki, Japan). After animals were trained for 26 days, Golgi-stained cerebellar tissues were prepared for HVEM observation. For the morphological analyses of dendritic spines, the AC rats showed a statistically significant increase in spine density and length than control (MC) animals (For density, AC: 27.49± 0.61/10μm, MC: 22.82± 0.51/10μm, p <0.05; For length, AC: 1.12± 0.01μm, MC: 1.03± 0.01μm, p <0.05). Dendritic spines were also classified into thin, mushroom, stubby, branched, and unclassified type by their distinct morphological features. On the tertiary branches of Purkinje cell dendrites, AC animals exhibited a tendency to have more thin and branched type spines, whereas a slight decrease in mushroom and stubby type was observed. The percentage increase in thin and branched type supports the result of increased spine length in AC group. These results suggest that motor learning increases the number of spines, implying that synaptogenesis occurs between parallel fibers and Purkinje cell spines. It is also plausible that the increased spine length could have an effect on the enhancement of contact probability between pre and postsynaptic sites in AC animals.
These data have not been published yet because other supplementary or additional experiments are ongoing.
【追加情報】(調査月2007年8月、記入月2008年6月)
発表論文
発表論文
学会報告