片桐 展子(東京女子医科大学・総合研究所・研究部)
有井 達夫
photic vesicle(PV) は小胞体(ER)の特殊形の一つで,軟体動物・腹足類の感杆型光受容細胞内に多量に含まれる。特異なロドプシン-レチノクロム系を構成するレチノクロムの局在部位である。PVは通常の固定切片ではclear vesicleであるが,加温オスミウム染色によってERやゴルジ層板と同様に黒染し,明瞭に識別できる。0.3mmの準薄切切片では一枚の切片内に完全な形のPV(径80nm)が存在する。金コロイドのようなマーカーを付けていない,加温オスミウム染色後エポン包埋した切片を用いて,電顕トモグラフィーによりPVの形態,分布およびERやゴルジ層板との関連を観察,立体視することを試みた。材料と方法は「生理研年報25,26」を参照。
【結果と考察】
1) マーカーを付けない加温オスミウム染色した切片において,電顕トモグラフィが可能であった。
2) トモグラフィー解析ソフトIMODによる傾斜像の位置合わせは金コロイドのマーカーがなくても,原画像を立体構築ソフトDeltaViewerで予め位置合わせしたデータを用いて行うことができた。
3) IMOD処理のデータを,再度DeltaViewerに移して処理,三次元立体構築ができた。構築像は自由に回転可能であった。
データを2つのソフト間で移動させるには,コンピュータ処理の専門の知識が必要である。また,超高圧電顕のすぐれた高解像度によって細胞基質の微細構造などが撮影される。それらは構築目的の構造と同じコンストラストを持つことが多く構築像に組み込まれるため,そのままのデータではよりよい構築が難しかった。目的の構造を特定するため,周辺の微細な基質をphotoshopなどにより削除する補正処理が必要であろう。
撮影は構築する範囲を考慮して撮影倍率を決め,目的の構造と傾斜軸をフィルム面の中心に置き,撮影途中で電顕を停止,再始動をしない,一定の条件で,同一日内に行ったほうがよい。また,フイルムデータをスキャナーでとり込む際,目的の構造を含めて少し大きめに(画像のサイズ1MB以内)切り取る。デジタル化したデータはDeltaViewerを利用し,photoshopなどにより,明るさ,コントラストを全データが一様になるように調整・補正する。なお,DeltaViewerによる位置合わせ後の保存は画像が低下するので,位置合わせは丁寧に何度も行い,保存は一度のみにする。
これらの補正・処理によって,DeltaViewerとIMODの併用で目的の構造の電顕トモグラフイが可能である。
日高 聰(藤田保健衛生大学医学部生理学教室)
最近,様々なニューロン間で電気シナプスが存在することが分かって来た。また,ニューロンで発現するコネクシン36が解明され,実験手法を組み合わせて使うことが可能になった。まず,電気生理学的に電気シナプスの機能を解析したニューロンを細胞内標識する。次に,切片を作成して電気シナプスの形態を同定すると共に,5mmの厚さの切片を利用し,1,000kVの加速電圧の超高圧電子顕微鏡下で解析することによって,電気シナプスを形成するニューロンの樹状突起の立体構造を解明する。さらに,コネクシンの特異抗体を作成し,蛍光染色したニューロンに,抗コネクシン抗体を用いた免疫細胞化学法を適用し,共焦点レーザースキャン顕微鏡で解析することによって,樹状突起間の電気シナプスの部位を特定できるようになった。
主要な視覚系の興奮性ニューロンである網膜神経節細胞は,網膜内の視覚情報の処理結果を脳の視覚中枢に送っているが,細胞間の同期興奮にどのような視覚情報が含まれているかを明らかにするために,a型網膜神経節細胞間のギャップ結合の機能形態解析を行なった。Dual whole-cell patch-clamp法によって通電実験を行い,電気シナプスの形成度を判断した。二連の電圧固定法を適用して,細胞間電流を測定し,細胞間チャネルのコンダクタンスを測定した(最大2.45 nS)。実験した細胞ペアは同期して活動電位を発生した。細胞ペアをLucifer yellowで標識し,抗コネキシン36抗体と反応させ,共焦点レーザースキャン顕微鏡で観察した。樹状突起間の交叉して接触している所に,抗コネキシン36抗体の免疫反応の斑点を観察し,免疫反応はその接触部位だけにあることが分かった。免疫反応の斑点を解析した結果,樹状突起間の接触部位は平均7つであった(n = 12)。免疫反応の斑点は微細形態的にギャップ結合であった。一方,tracer couplingを示した標本から5mmの厚さの切片を作成し,1,000kVの加速電圧の超高圧電子顕微鏡で解析した。接触した樹状突起の様子を立体的に観察し,接触部位はclose membrane appositionの形態を呈することが分かった。超薄切片を作成し,接触部位を解析して,ギャップ結合を同定した。超高圧電子顕微鏡の解析標本から,close membrane apposition形態の接触領域を計測することによって,ギャップ結合斑の大きさを測定した(平均直径0.86mm, n = 14)。以上のことから,隣り合うa型網膜神経節細胞間で,接触した樹状突起の構造を微細形態学的に同定したが,抗コネキシン36抗体を用いた免疫細胞化学法による解析からその接触部位にはコネキシン36で構成されるギャップ結合が存在することがわかった。
文献
【追加情報】(調査月2007年8月、記入月2008年6月)
発表論文
関係論文
遠藤 泰久・吉村 亮一・西田 倫希(京都工芸繊維大学)
有井 達夫
神経細胞の突起の途中に形成される数珠状の膨大部,varicosityはシナプス形成に関わるだけでなく,脳内や末梢組織における非シナプス的情報伝達部位として機能している。我々のこれまでの培養細胞を用いた研究により,varicosityの形成頻度が標的細胞との混合培養によって増加すること,anterogradeだけでなくretrogradeにも移動すること,微小管形成阻害剤taxolにより動きが抑制されることなどが明らかとなっている。しかし,その形成機構はほとんど不明のままであり,超高圧電子顕微鏡による3次元構造解析を試み,有芯小胞などの分布を観察した。
ホルムバール支持膜を張った金メッシュを70%エタノールで滅菌後,コラーゲンコートを施し,副腎髄質褐色細胞腫由来の細胞株PC12細胞をDMEM培地にNGF(最終濃度50nm)を添加し4日間培養した。細胞を4%パラフォルムアルデヒド+0.1%グルタルアルデヒドデ固定後,1%オスミウム酸で後固定した。エタノール系列で脱水後,二酸化炭素-臨界点乾燥した。脱水の途中,酢酸ウランでブロック染色を施した。試料をカーボン蒸着後,超高圧電子顕微鏡(H-1250M 加速電圧1000kV)により,同一視野を-60度から+60度まで2度刻みの傾斜連続写真を撮影し,IMODにより3次元画像解析を行った。
varicosityの大きさは数mmの範囲で様々で,形は一般に紡錘形をしているものが多い。また,今回の観察に供した部位のように,三角錐形で神経突起の分岐点になっている場合もしばしば見られる。交感神経細胞様に分化するPC12細胞のvaricosity内には多数の有芯顆粒が存在し,断層像を観察した結果,細胞膜に近い周縁部や,培養基質に近い下部に高密度に存在することがわかった。今後,細胞骨格や細胞小器官の分布の微細な3次元的解析を進めることにより,varicosity の形成機構を明らかにしていきたい。
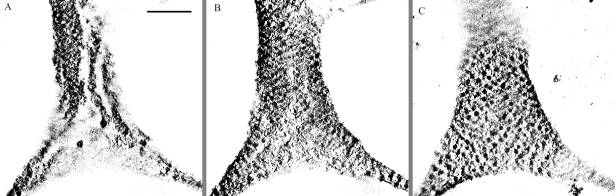
図:PC12細胞のvaricosityの断層像 A.上部,B.中部,C.下部。Bar=1mm
【追加情報】(調査月2007年8月、記入月2008年6月)
発表論文
野田 亨(藍野大学医療保健学部 理学療法学科)
細胞骨格の主要な構成要素は微小管,中間径フィラメント,そしてアクチンフィラメントであり,発見当初は細胞の骨組みを決定するものとして解釈されたが,その後,それぞれに多彩な機能が明らかになりつつある。しかしながら,まだ多くの未知なる機能が予想されている。
近年,岩月らの報告によると,いくつかの上皮細胞においては中間径フィラメントであるケラチンフィラメントがゴルジ装置周辺で集中的に分布することが見いだされた。本研究ではこの指摘から細胞全体のケラチンフィラメントがゴルジ装置特有の形態の維持や分泌現象と関係するか否かという疑問に答えるべく,ケラチンフィラメントとゴルジ装置の三次元的空間配置を免疫細胞化学的に標識した試料を超高圧電顕で捉えることを研究目的とした。
ラットの小腸組織を固定後,その凍結切片を作製し,抗ケラチン抗体,および抗ゴルジ抗体を用いて酵素抗体法による免疫組織化学的標識を行い,樹脂で包埋した。試料から1mm厚の切片を作成し,生理学研究所の超高圧電子顕微鏡(H-1250M)で観察を行った。しかし,今回用いた酵素抗体法による検討ではゴルジ装置付近に明瞭な立体的構造を示す反応産物を確認することが困難であった。この実験系にはまださらなる継続的な研究が必要と考えられた。
樋田一徳(徳島大学大学院ヘルスバイオサイエンス研究部)
嗅覚神経系は,化学的性質と形態的特徴から基本的脳神経回路の研究対象として魅力的であり,従来より嗅球ニューロンの三次元的な微細構造を超高圧電子顕微鏡(電顕)によって解析を進めてきたが,本年度はニューロンと共に神経回路構築に関わるグリアについて,ラット嗅球の外網状層と顆粒細胞層について解析を行った。
嗅球は異種複数の神経要素間のreciprocal synapse や serial synapse が特徴的であるが,近傍でシナプス結合を整然と構成するようにグリアが頻繁に観察される。免疫電顕の超薄連続切片による解析から,このグリアはアストロサイトで,薄いシート状の構造がシナプス結合を形成する神経終末,棘状突起,樹状突起の周囲を断続的に覆っていることが推測されるが,その全貌を把握するのは困難であり,超高圧電顕による厚い切片試料による立体解析が最も有用と考える。
嗅球の外網状層は,投射ニューロンの二次樹状突起と各種介在ニューロン及び各種ニューロンによる遠心性及び回帰性入力が相互にシナプス結合を形成している。この領域のアストロサイトは,ゴルジ染色による超高圧電顕立体像では,細胞体から派生する一次突起及び一次突起より分枝する二次突起から薄いシート状の構造が観察され,これが径2-3mmから0.5mmの中空の筒状の構造を呈し(図1),表層では径が比較的小さく深層では大きい傾向にある。これまでの解析から,この構造はグリアが取り巻く各種神経要素の存在の反映と考えられる。
顆粒細胞層では,突起から派生するシート状構造は隣接の顆粒細胞の細胞体を断続的に直接覆っている(図2)。顆粒細胞は通常数十個単位で島状に存在しており,グリアが同一の顆粒細胞群を取り囲んでいる像が観察された。これら顆粒細胞は同一の細胞から由来するGABAニューロン群と考えられているが,GABA免疫反応性は一様でなく代謝機能も多様であるとも考えられ,これにグリアがいかに関与するかが興味深いところである。
今後も超薄切片所見と慎重に対応させながら,超高圧電顕を用いたニューロンとグリアの詳細な構造解析を行う予定である。

|
図2:嗅球顆粒細胞層のアストログリアの5mm厚切片の立体像 (±8°)。複数の顆粒細胞を突起で取り囲んでいる。Bar=10mm
|
図1:嗅球外網状層のアストログリアの5mm厚切片の立体像 (±8°)。Bar=10mm |
松田 純子(東海大学未来科学技術共同研究センター糖鎖工学研究施設)
樋田 一徳(徳島大学大学院ヘルスバイオサイエンス研究部形態情報医学分野)
我々は最近,新たにセラミド代謝障害モデルマウスであるサポシンD欠損マウスを作製し,parasagittal stripeに一致した小脳プルキンエ細胞の選択的細胞死を見出した。小脳プルキンエ細胞では様々な分子が矢状方向にゼブラ状の発現パターンを示すことが知られているが,その生理的役割は明らかになっていない。セラミド代謝関連酵素であるsphingosine kinaseが小脳プルキンエ細胞においてparasagittal stripeに一致した発現パターンを示すことなどから,スフィンゴ糖脂質代謝は,正常の小脳プルキンエ神経細胞回路において重要な生理的・病理的役割を果たしていると推定される。そこで,小脳プルキンエ細胞の情報処理とparasagittal compartment神経回路機能に対するスフィンゴ糖脂質代謝の役割を解明する為に,超高圧電子顕微鏡の高解像力を利用して,サポシンD欠損マウスの小脳の詳細な三次元微細構造解析を行なうのが当該実験の目的である。
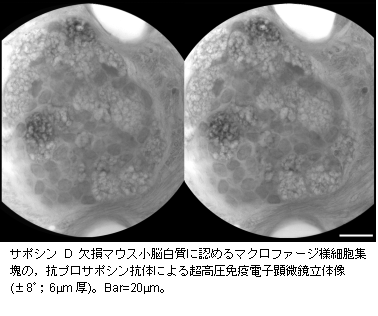
最近我々は,独自に作成したサポシンDの前駆体タンパクであるプロサポシンに特異的なペプチド抗体を用いてサポシンD欠損マウス脳の免疫組織化学解析を行ったところ,サポシンD欠損マウスの小脳プルキンエ細胞にはプロサポシンが強く発現し,更に小脳白質の血管周囲に認める多核マクロファージ様細胞がプロサポシン免疫強陽性であることを見出した。そこで超高圧電子顕微鏡を用いてこの多核マクロファージ様細胞を立体的に観察したところ,大小様々な泡沫状の封入体(光顕ではPAS陽性)を多数含有するプロサポシン免疫陽性細胞が数十個単位で集塊状をなして,血管及び有髄線維束に近接して存在していることが明らかになった(付図)。
今後はプロサポシン抗体に加え,各種神経系細胞マーカーを用いた免疫細胞化学法,各種トレーサー生体内注入による細胞標識,及びゴルジ鍍銀法により,小脳の各種細胞を標識した超高圧電子顕微鏡観察標本を作製し,野生型マウスを比較対照群として,サポシンD欠損マウスの小脳における神経回路構造変化と小脳プルキンエ細胞の構造変化・変性・消失過程について三次元構造解析を進めていく予定である。
小曽戸陽一(ドイツ・マックスプランク研究所・Molecular Cell Biology and Genetics)
樋田一徳,清蔭恵美(徳島大学大学院・神経情報医学部門・情報統合医学講座・形態情報医学分野)
有井達夫
神経上皮細胞は,中枢神経系の神経細胞,およびマクログリア細胞の前駆細胞である。神経上皮細胞は主にneuroepitheliumのapical表層で細胞分裂を行うが,脳発生の初期には細胞増殖のための対照的な分裂,その後神経細胞を生み出す非対称的分裂(一つの神経上皮細胞から,神経上皮細胞および神経細胞が生成する)がより多く見受けられる。近年の観察により,分裂期では細胞体とbasal laminaのコンタクトは大変細長い形状(直径1mm以下,長さ100mm以上)となるものの,プロセス様の構造物(basal process)として保持されていることが見受けられた。しかしながら,細胞分裂の際にbasal processがどのように娘細胞に引き継がれるかについては不明な点が多い。現在までの報告では,basal processはその極めて細長い構造上,細胞分裂の際には分裂することはなく,どちらかの娘細胞に不均等に分配されると考えられてきた。その不均等な分配が娘細胞の非対称な運命決定(増殖的あるいは神経生成的)に働いているとの示唆もある。我々は,basal processの形態学的情報を得るためには電子顕微鏡観察が必要であると考え,厚い試料(~5mm)の観察が可能である生理学研究所の超高圧電子顕微鏡(HVEM,H-1250M)によるbasal processの観察を行った。
マウス10.5日胚の神経上皮細胞のbasal processの微細構造を評価するため,電子顕微鏡を用いた観察手法の確立を行った。我々はゴルジ染色法とHVEMを組み合わせることによりbasal processを可視化することを試みた。Basal process内にはある頻度で瘤状構造物が存在するが,HVEMによる立体解析で,この構造物がM期様の細胞では二つに分かれている様にみられ,またそのそれぞれが細胞体とbasal processを介して結合している様子が観察された。この結果はM期において,basal processが細胞体分裂より前の段階で分裂している可能性を示唆した。
Kea Joo Lee, Im Joo Rhyu
(Department of Anatomy College of Medicine Korea University, Seoul Korea)
Synapses are specialized interneuronal junctions where signals are propagated from one to another. Most excitatory synapses consist of presynaptic axon terminals and postsynaptic dendritic spines in a mammalian central nervous system. Shapes and number of dendritic spines are dramatically changed under various physiological or pathological conditions such as development, environmental enrichment, learning, hormonal states,ataxia, and mental retardation.To analyze dendritic spines quantitatively or qualitatively, light microscopy (LM), laser confocal microscopy, transmission electron microscopy (TEM), and HVEM have been generally used. Because dendritic spines are numerous and small in size, standard LM may not adequately identify spine morphology. The profiles of dendritic spines appear to be fragmental in thin sections for TEM; thus, without an adequate 3-D reconstruction method, TEM is not suitable for quantifying structural dimensions and composition of spines. HVEM has been effectively applied to quantitative studies of spines by using 3-5 mm thick sections and taking advantage of its high resolution and penetrating power.
We have analyzed the detailed morphology of the dendritic spines in hippocampal neurons and Purkinje cell in some physiologic and pathologic conditions with HVEM. The density, length and spine have been analyzed in the acrobat trained rat, P/Q type calcium channel mutant, and fmr-1 knock out mice, which is an animal model of human fragile X syndrome. The density and length of Purkinje cell dendritic spine were increased in the acrobat trained rat cerebellum. But the density and length of the dendritic spine of Purkinje cell were decreased in the P/Q type calcium channel mutant. The increased spine density and length of fmr-1 knock mice were observed in dentate granule cell of the hippocampus.
The HVEM provide a useful tool in synaptic plasticity studies and in extracting 3 dimensional information of the nervous system.
濱 清(生理学研究所)
Ellisman, M.H. (UCSD,NCMIR)
ラット歯状回顆粒細胞樹状突起の長さ,表面積,体積に関する定量的な報告を,ステレオ解析により行ってきた。これらは光学顕微鏡では解像できない微細な構造をとって機能を発揮しているので超高圧電子顕微鏡による解析によってはじめて定量的な情報があきらかとなる。これらの3次元的情報をより定量的に求めることを目的に,3~5mm厚のエポン包埋切片を用いて±60°の範囲内で2度おきに連続傾斜像(61枚)を撮影し,これらの傾斜像を用いてコンピュタートモグラフィー (CT) 手法により三次元再構築を行ってボクセルデータを得た。ボクセルデータから表面積,体積などを求めている。このときに,直径が大きい樹状突起に近接するスパインでは,傾斜して撮影する方向によって,得られる三次元構造に変化する場合があるので,三次元再構築手法と定量的な値を求める手法を再検討しているところである。
InSun Kim (Keimyung University)
Sung-Sik Han(Korea University)
Part 1
The crystalline bodies (Cr) were distinghished in early development of mesophyll etioplasts. The etioplasts contained prolamellar bodies, abundant starch grains, prominent Cr, few plastoglobuli, and thylakoid system. Arrays of Cr frequently occupied a large volume, roughly up to 40-50%, of the plastids, at times nearly extending throughout the stroma. The patterns of tubular elements exhibiting both paralleled and paracrystalline arrangements within one Cr were of particular interest. In a longitudinal section, paralleled tubular elements were well-demonstrated, sometimes reaching up to 6-7 mm in length. Hexagonal arrangement of the tubular elements within the Cr was clearly demonstrated in transverse sections of thin- and thick-sectioned specimens. In the paracrystalline Cr, the plane approximately at right angle to the long axis of the structure consisted of a network of tubular elements. Each tubular element appeared as a central hexagon with an internal diameter of 18 nm. The hexagons formed a star-like pattern where each side of the hexagon was joined by six equilateral triangles. Optical diffraction analysis performed on the paracrystalline Cr showed a strong hexagonal pattern.
Part 2
Rhabdomere formation - Photoreceptor morphogenesis demands a high level of performance by mechanisms mediating directed membrane traffic. However, rhabdomere biogenesis is a complicated process yet to be fully characterized. In Drosophila, the retina of early pupal stage at 48~72 hours exhibited an extensive growth of the photoreceptor apical domain that resulted in the rhabdomere formation by giving rise to stacks of membrane packed with a photopigment, rhodopsin. At least three types of vesicles, namely double- and single-membranous vesicles, and electron dense vesicles, were believed to be involved in the rhabdomere development. The double-membranous vesicles were closely associated with the rhabdomere that connected to their enfolded membranes. In addition, rhodopsin immuno-positive signal was detected in the single-membranous vesicles where they were fused with rhabdomeres. The electron-dense vesicles were also observed near the rhabdomeres, and their involvement has been also suggested during rhabdomere formation. Significant role of these vesicles were speculated for the rhabdomere biogenesis in Drosophila.
発表論文
学会報告