|
ATP用語説明1は、細胞内のさまざまな反応のエネルギー源や、エネルギー通貨としての役割を担っています。ATPはいったん細胞外に放出されると、当の細胞や他の細胞にアラームシグナルを伝えるシグナル伝達分子として働くことが知られています。陰電荷をもつATP(その大きさは1.1-1.3 nm)が細胞外へ放出されるにはいくつかの経路がありますが、最も能率的な経路として、アニオンチャネルの開口部(ポア)を通る経路が考えられます。私たちはこれまでの研究から、マキシアニオン(Maxi-Cl)チャネルと呼ばれる、大型のポア(直径1.1-1.5 nm)を持つアニオンチャネルが、心筋や脳、腎臓などでATP放出性イオンチャネルとして機能していることを示してきました。しかし、このMaxi-Clチャネルがどのようなタンパク質から構成されているのかは、長い間謎のままでした。 今回、生理学研究所の岡田俊昭特任准教授とサビロブ・ラブシャン客員教授、岡田泰伸名誉教授、滋賀医科大学の松浦博教授らの研究グループは、ウズベキスタン国立科学アカデミー生物有機化学研究所、総合研究大学院大学、基礎生物学研究所、仁愛大学、京都府立医科大学との共同研究によって、このMaxi-Clアニオンチャネルの分子同定に初めて成功し、心臓疾患のひとつである心筋梗塞の急性期に、細胞のアラームシグナルとして働くATPの放出通路として、Maxi-Clアニオンチャネルが使われていることを世界で初めて発見しました。 本研究結果は平成29年10月18日、欧州分子生物学機構EMBO Journalオンライン版に掲載されました。 |
マキシアニオン(Maxi-Cl)チャネル用語説明2は、通常静止(閉口)状態にありますが、さまざまな生理的、病態的条件下において様々な刺激によって活性化して開口します。活性化したMaxi-Clチャネルからは、陰電荷をもつイオン(アニオン)や低分子有機物質がチャネルのポアを通って細胞内から細胞外へ放出されます。細胞が低浸透圧に曝されて膨らんでしまった場合には、この放出によって細胞容積を元に戻し、細胞が死んでしまわないように調節する役割を果たします。しかしそれ以上に注目されるのは、Maxi-Clチャネルのポアのサイズが大きいことによって、放出される物質の中にATPが含まれてしまうことです。細胞外に放出されたATPは、細胞膜上のATP受容体を刺激して、当の細胞や周囲の細胞に働きかけ、結果、アラームシグナルとして種々の機能を引き起こします(図1参照)。
今回岡田俊昭特任准教授らの研究グループは、Maxi-Clチャネルを構成するコア分子がSLCO2A1(solute carrier organic anion transporter family, member 2a1)タンパク用語説明3であることを発見しました。
このSLCO2A1タンパクは、プロスタグランジントランスポータ(PGT)用語説明4として働くことが既に知られています。今回の研究では、SLCO2A1タンパクのプロスタグランジン輸送機能を阻害することが知られる薬剤や、PGT機能を減少させるSLCO2A1変異が、Maxi-Clチャネル電流を顕著に抑制することを示しました。
更に、心臓で虚血-再灌流を起こすと、心筋などからATPが放出されることが知られていますが、このATPは虚血-再灌流後に起こる細胞障害を緩和するという報告があります。今回、SLCO2A1をあらかじめノックダウンしておいたマウスの心臓を用いて虚血-再灌流モデル実験用語説明5を行い、このときの心臓におけるATP放出にもSLCO2A1が関与していることを示しました(図2)。
さらにSLCO2A1タンパクのプロスタグランジン輸送機能を阻害することが知られる薬剤や、PGT機能を減少させるSLCO2A1の変異によって、Maxi-Clチャネルの活性化が顕著に抑制されることを示しました。この事実は、SLCO2A1タンパクがMaxi-Clと呼ばれるATP放出性イオンチャネルと、PGTと呼ばれるトランスポータという2つの重要な機能を併せ持つことを示しています(図3)。
Maxi-Clチャネルのコア分子が見つかったことで、Maxi-Clチャネル機能のさらなる詳細な解析が可能になりました。またMaxi-Clチャネルを通じたATP放出が生体に与える影響についても、今後さらなる理解が進むことが期待されます。特に、心筋の虚血-再灌流障害に対して、保護作用をする細胞外ATPの放出通路分子が明らかになったことから、心臓の虚血プレコンディショニング用語説明6のメカニズムの解明や、急性期心筋梗塞の新しい治療法・予防法の開発へと進むことが期待されます。
本研究は、日本学術振興会のH26-29年科学研究費補助金基盤研究B「ATP放出性マキシアニオンチャネルの分子同定と心筋虚血・再灌流障害への役割解明」(代表者:岡田泰伸 総研大前学長)、H28-30年基盤研究C「ATP放出性Maxi-Clチャネル関連分子の解析」(代表者:岡田俊昭 生理研特任准教授)による支援を受けて行われました。
なお、本研究論文内容とその重要性は、本論文掲載誌のNews & Review記事(DOI 10.15251/embj.201798304)として同日に紹介されました。
用語説明1;ATPアデノシン三リン酸。生体内で使用されるエネルギーを蓄えており、その蓄えたエネルギーを放出することで様々な反応や代謝を進行させるという生体にとって重要な働きを担う分子である。その重要性から、「生体内のエネルギー通貨」とも形容される。
用語説明2:マキシアニオン(Maxi-Cl)チャネル;長い間実体が不明だったイオンチャネル(細胞の膜を貫通して、イオンの通り道となるポアを作るタンパク質の総称)の一つ。マキシアニオンチャネルは、陽電荷イオン(カチオン)は殆ど通さずに、陰電荷イオン(アニオン)を通すというアニオンチャネルの一つであり、アニオンチャネルの中で最大のポアを持つので、比較的大きな陰電荷有機物質(例えばATP)の通り道ともなる。
用語説明3:SLCO2A1タンパク;陰電荷の有機物質を細胞外から内へ、又は細胞内から外へ輸送する働きをする有機アニオン輸送体(solute carrier organic anion transporter)タンパクの一つ。一般に輸送体タンパクはトランスポータと呼ばれる。SLCO2A1はプロスタグランジンを細胞外から細胞内へ輸送する(取り込む)働きをする。
用語説明4:プロスタグランジントランスポータ(PGT);プロスタグランジンの輸送を行うトランスポータ(輸送体タンパク)。プロスタグランジンは生理活性物質の一種で、血圧低下、血管拡張、血小板凝固、子宮収縮、発熱、疼痛発生等、生体にとって重要な、様々な作用を持つ。
用語説明5:虚血-再灌流モデル実験;虚血は「血管が詰まったり圧迫されたりして動脈血の供給が急激に減少・停止する」ことで、虚血を起こした組織では酸素や栄養が不足する。動脈血の供給が再開されることを再灌流と呼ぶ。虚血-再灌流モデル実験は、人為的に虚血とそれに続く再灌流を起こしてそれらが組織や細胞に与える影響を調べるために行われる。
用語説明6:心臓のプレコンディショニング;先行する一過性の心筋虚血が繰り返されることでその後の持続性心筋虚血に対する耐性が獲得され、心筋梗塞サイズを縮小して予後の改善につながる現象。
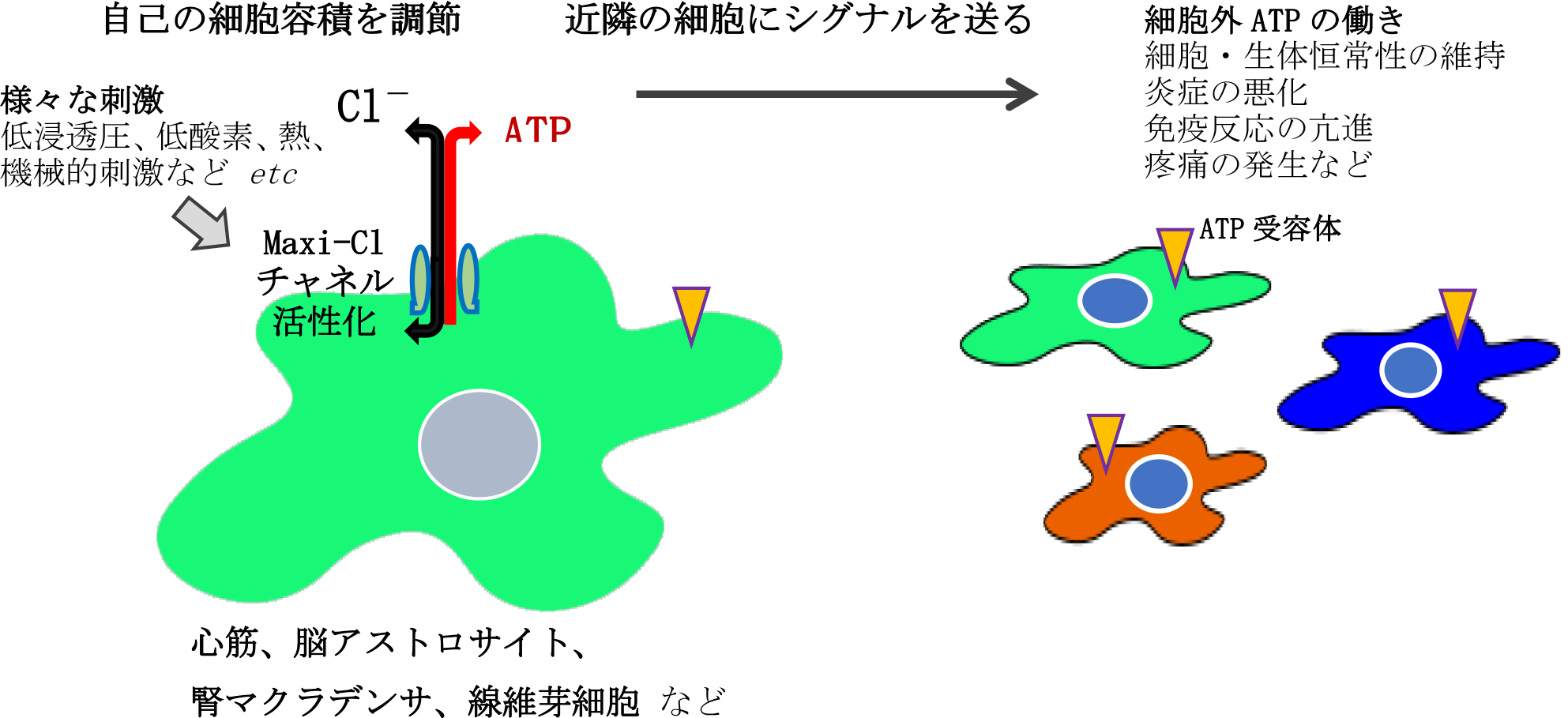
細胞外に放出されたATPは、細胞膜上のATP受容体を介して当の細胞や周囲の細胞に働きかけます。ATPは細胞の正常な増殖・分化・移動を促したり、体液量・ナトリウム濃度を一定に保つための腎機能のシグナルとなるなど、生体の恒常性を維持する役割を果たしますが、一方で炎症やアレルギー反応のような病態的局面においては症状を悪化させる、生体にとって負と成り得る側面も併せ持つことが知られています。Maxi-Clチャネルは、様々な種類の細胞に発現し多様な刺激に応じて活性化することから、生体内の様々な局面において細胞外に放出される陰荷電ATPの多くはMaxi-Clチャネルのポアから放出されていると予想されます。つまり、Maxi-Clチャネルの活性化によってATPが放出されることで、当の細胞と近隣の細胞にシグナルを送り、生体にとって正負の様々な反応が引き起こされている可能性があるのです。
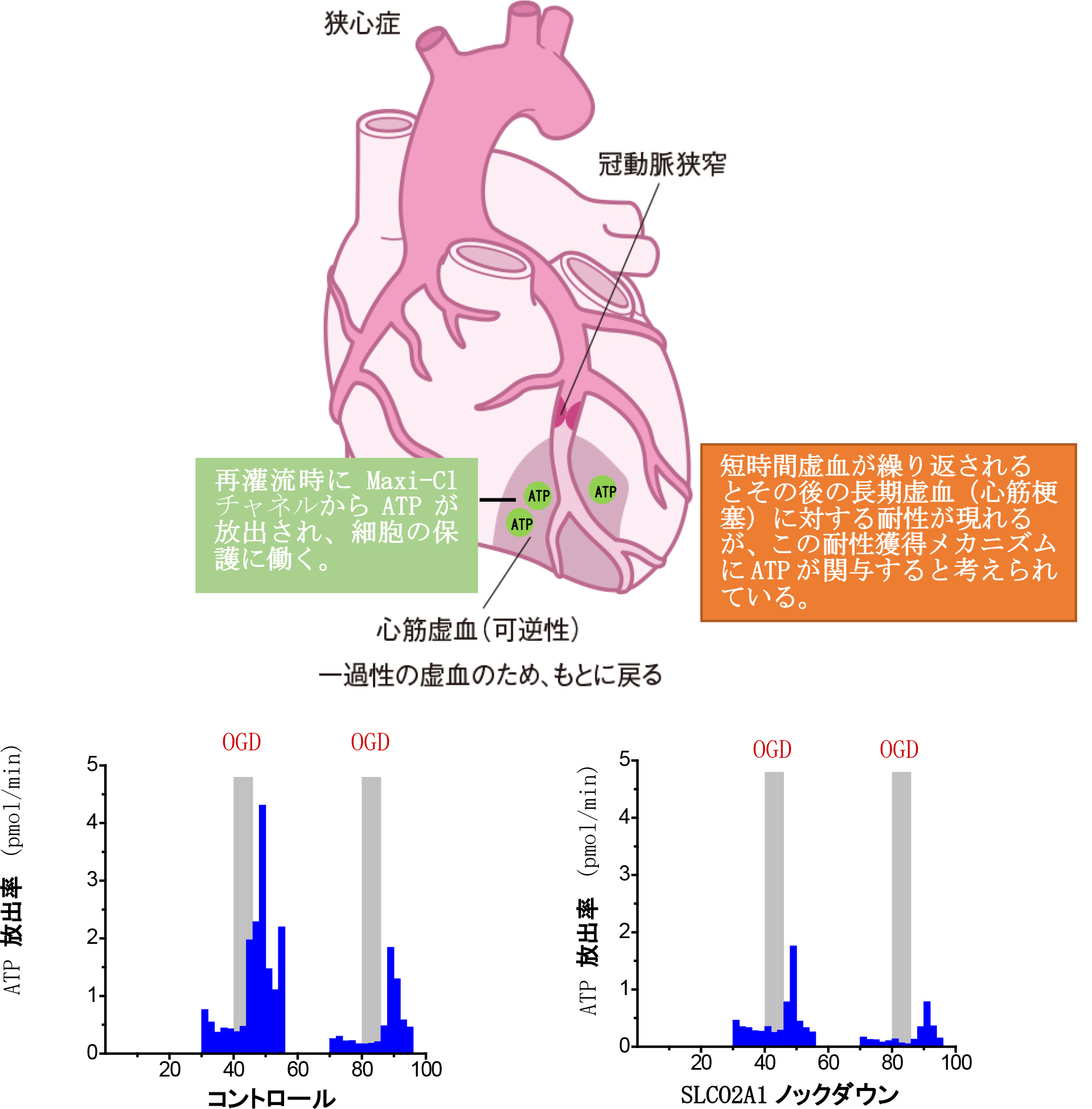
マウスの心臓を用いて虚血-再灌流モデルを作成し、再灌流直後にATPが心臓の細胞から放出されることを示しました(左下グラフ)。グラフの青棒が放出されたATP量、灰色棒は虚血期間を表しています。事前にSLCO21タンパクの発現をノックダウンしておくと、放出されるATPの量が減少する(右下グラフ)ことから、このATP放出にSLCO2A1(Maxi-Clチャネル)が関与していることが示されました。
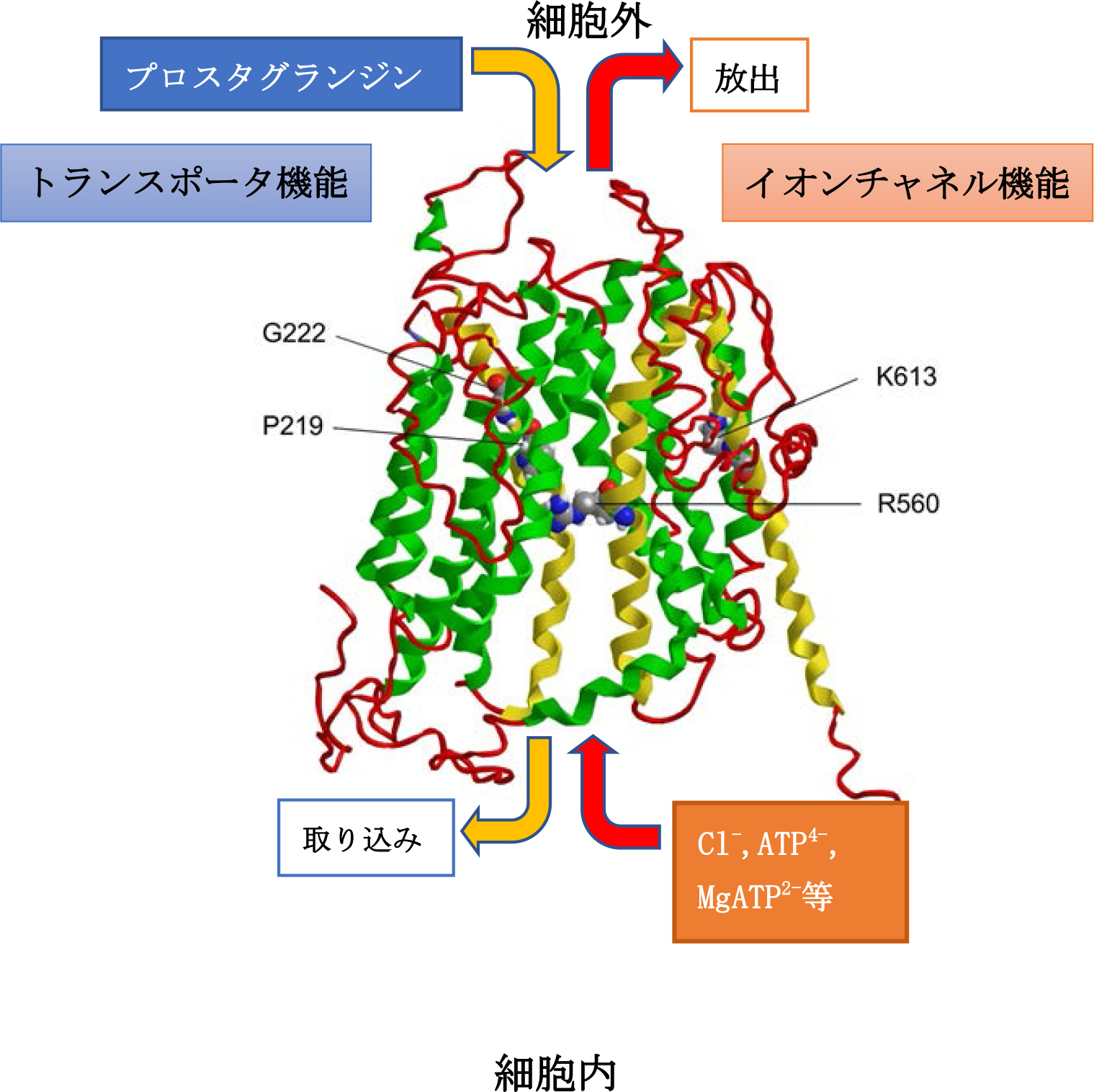
細胞外に放出されたATPは、必要時に細胞の増殖や移動を促したり、細胞死を防いだりすると共に、体液量が増加したり体液ナトリウム濃度が増加した時にそれらを元にもどすための腎臓機能のシグナルとなるなど、恒常性を維持するという生体にとって有益な反応を示します。一方で、場合によっては炎症を悪化させたり、疼痛などの痛みの発生原因となるなど生体に不利益な反応をもたらすこともあるため、医学的観点から広く注目されています。しかしATPの放出メカニズムの中でも、特にイオンチャネルの開口部を通じて行われるATP放出に関する知見は、充実しているとは言い難い状況でした。
今回の発見は、多様な細胞においてさまざまな状況下でみられるATP放出の分子メカニズムを解明した世界で初めての発見であり、今後この成果を基にATP放出を伴う、さまざまな生理学的・病理学的現象について分子論的な理解が深まることが期待されます。
また病態学的な現象に関しては、今後このMaxi-Clチャネル/SLCO2A1をターゲットとすることにより、心臓や脳における虚血-再灌流時に発生する組織のダメージ(心筋梗塞、脳梗塞)を軽減するような治療法の開発などの一助となることが期待されます。
【論文全著者】
Ravshan Z. Sabirov
(生理学研究所客員教授、ウズベキスタン国立科学アカデミー生物有機化学研究所 教授)
Petr G. Merzlyak
(生理学研究所客員准教授、ウズベキスタン国立科学アカデミー生物有機化学研究所 教授)
岡田 俊昭(生理学研究所 特任准教授)
Md. Rafiqul Islam(生理学研究所 博士研究員)
浦本 裕美(仁愛大学 准教授)
森 友子(基礎生物学研究所 主任技術職員)
牧野 由美子(基礎生物学研究所 技術職員)
松浦 博(滋賀医科大学 教授)
Yu Xie(滋賀医科大学 博士研究員)
岡田 泰伸(生理学研究所 前所長・名誉教授)
The organic anion transporter SLCO2A1 constitutes the core component of the Maxi-Cl channel.
Ravshan Z. Sabirov, Petr G. Merzlyak, Toshiaki Okada, Md. Rafiqul Islam, Hiromi Uramoto, Tomoko Mori, Yumiko Makino, Hiroshi Matsuura, Yu Xie, and Yasunobu Okada.
The EMBO Journal 2017 (in press): http://emboj.embopress.org/cgi/doi/10.15252/embj.201796685
<研究について>
自然科学研究機構 生理学研究所 細胞生理部門
特任准教授 岡田俊昭 (オカダトシアキ)
京都府立医科大学 生理学教室
特任教授 岡田泰伸 (オカダヤスノブ)
滋賀医科大学 生理学講座 細胞機能生理学部門
教授 松浦博 (マツウラヒロシ)
<広報に関すること>
自然科学研究機構 生理学研究所 研究力強化戦略室
自然科学研究機構 基礎生物学研究所 広報室
国立大学法人 滋賀医科大学 企画(IR担当)課
仁愛大学 事務局




自然科学研究機構 生理学研究所
自然科学研究機構 基礎生物学研究所
国立大学法人 滋賀医科大学
仁愛大学