3559
研究部門メンバー
生後脳におけるニューロン新生のメカニズムと意義の解明
脳に内在する再生機構の解明と操作技術の開発
胎生期のみならず、生後の脳内においても限られた領域においても、神経幹細胞が存在し、持続的に新たなニューロンが産生されています。このニューロン新生が脳の発達や恒常性の維持に関わっていることが明らかになりつつあります。また、脳に傷害が生じた際には、ニューロン新生領域での細胞増殖が増加し、脳傷害によって失われたニューロンを再生させることも明らかになってきました。我々のグループでは、生理研の他の研究部門との共同研究によって、連続ブロック表面走査型電子顕微鏡(SBF-SEM)や二光子顕微鏡による解析を行うことで、新生ニューロンの移動メカニズムを明らかにしてきました。本研究部門においては、正常動物と脳傷害モデル動物を用いて、生後脳におけるニューロンやグリア細胞の新生メカニズムとその意義を解明し、新たな治療法の開発に役立てることを目指しております。
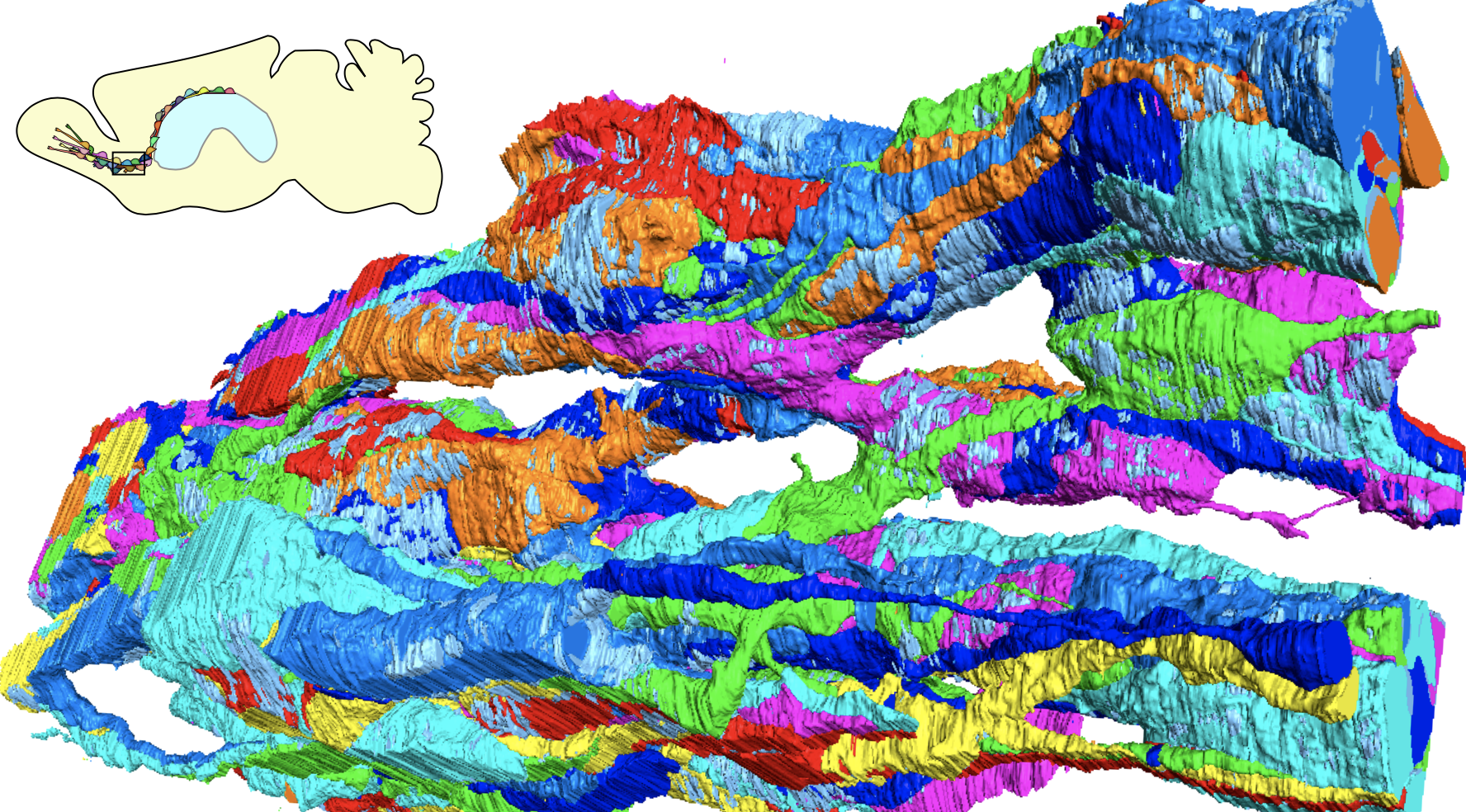
図1 SBF-SEMによって正常脳と傷害脳内を移動する新生ニューロンの微細構造を明らかにした(Matsumoto et al., 2024)。
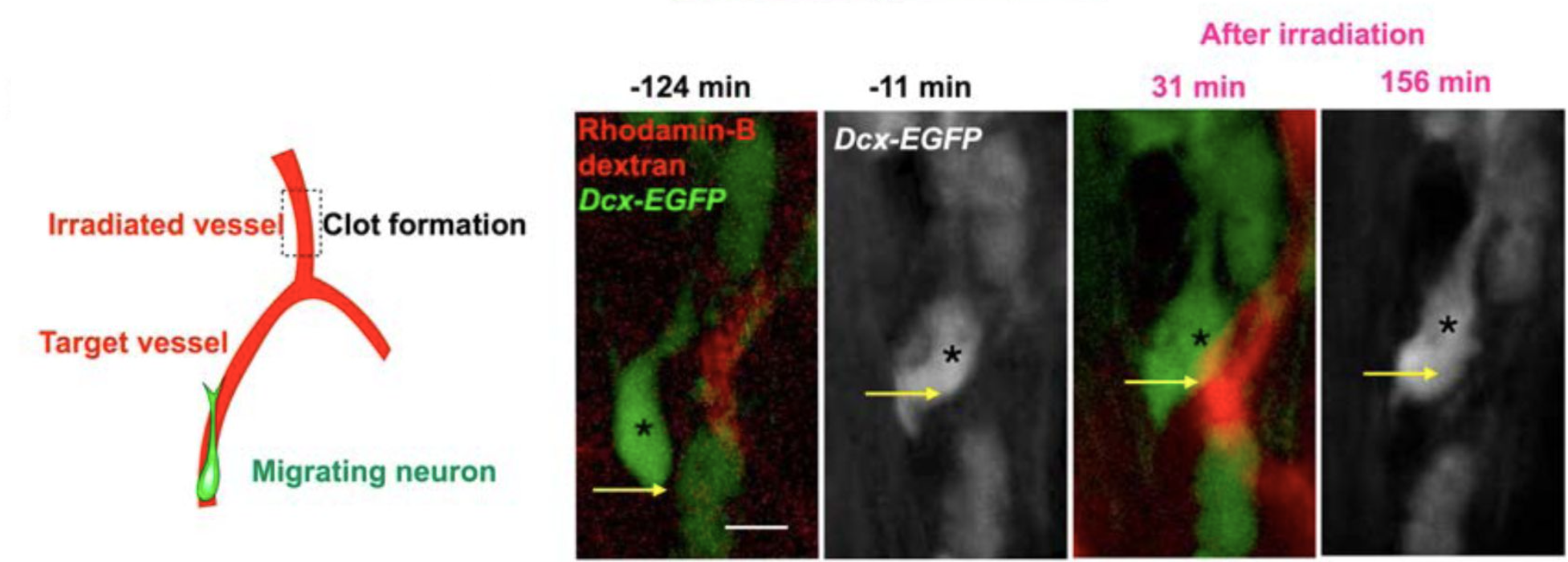
図2 二光子顕微鏡によって新生ニューロン移動が血流に依存することを明らかにした(Ogino et al., 2024)。
代表的な論文情報
*C. Nakajima et al., Identification of the growth cone as a probe and driver of neuronal migration in the injured brain. Nat Commun, 15, 1877. (2024)
*M. Sawada et al., PlexinD1 signaling controls domain-specific dendritic development in newborn neurons in the postnatal olfactory bulb. Front Neurosci, 17:1143130. (2023)
*Y. Ohno et al., Amphiphilic peptide-tagged N-cadherin forms radial glial-like fibers that enhance neuronal migration in injured brain and promote sensorimotor recovery. Biomaterials 294, 122003. (2023)
*C. Kurematsu et al., Synaptic pruning of murine adult-born neurons by microglia depends on photophatidylserine. J Exp Med, 219: e20202304 (2022)
*C. Nakajima et al., Postnatal neuronal migration in health and disease. Curr Opin Neurobiol, 66: 1-9. (2021)

