| ミトコンドリアは生命活動の根源を担う重要なエネルギー生成装置であり、ミトコンドリアの品質低下は細胞のエネルギー代謝機能異常を招き、重篤な病態や疾患を引き起こす原因になります。今回、自然科学研究機構生理学研究所(生命創成探究センター)および九州大学大学院薬学研究院の西田基宏教授と九州大学大学院薬学研究院の西村明幸講師らの共同研究グループは、ミトコンドリアの過度な分裂が慢性心不全の原因の一つである心筋細胞の早期老化を誘導する原因となることを明らかにしました。さらに、ミトコンドリアが過剰分裂するメカニズム(標的分子)を解明し、国が安全性を保証する既承認薬の中からミトコンドリア過剰分裂を抑制する薬(シルニジピン)を同定しました。実際、心筋梗塞後の心機能が完全に低下しきったマウスにシルニジピンを投与したところ、予後が顕著に改善されました。本研究成果は、ミトコンドリア品質維持による心筋修復を主眼とする心不全治療薬開発に大きく貢献することが期待されます。本研究成果はScience Signaling電子版(日本時間2018年11月14日午前4時解禁)に掲載されます。 |
心疾患による死亡者数は、日本国内で年間約20万人に上り、これはがんに次ぐ2番目の死因となっています。心疾患の中で、死因として最も多いのが心不全です。心不全患者の5年生存率は未だ50%であり、この50年間で10%程度しか改善されておらず、これまでの治療薬とは異なるコンセプトに基づいた薬の開発が必要とされています。
これまで私たちの研究グループは、心不全を増悪化させる要因として心筋細胞の早期老化現象に着目してきました。加齢とともに増加する心筋細胞の老化は、心臓の機能(収縮力)を低下させます。心筋梗塞などのいくつかの心疾患では心筋老化が顕著に増加しており、この心筋細胞の早期老化現象が心不全増悪化の一因であることを明らかにしてきました。今回、私たちは心筋細胞の早期老化が起こるメカニズムについて検証を行い、心筋ミトコンドリアの異常分裂がその引き金となっていることを明らかにしました。ミトコンドリアはエネルギー産生の中心を担う細胞内小器官であり、分裂と融合を繰り返すことで自身の品質(機能)を維持しています。心筋梗塞後の心筋細胞では、ミトコンドリア分裂制御分子Dynamin-related protein 1 (Drp1)が異常活性化することでミトコンドリア分裂が誘導されていました(図1)。また、アクチン結合蛋白質であるFilaminがDrp1と疾患特異的に複合体を形成しており、これがDrp1異常活性化の原因であることを発見しました。そこで、ミトコンドリア異常分裂を抑制する化合物を既承認薬の中から探索し、高血圧症治療薬であるシルニジピンを同定しました。シルニジピンはジヒドロピリジン系カルシウム拮抗薬の1つですが、別のカルシウム拮抗薬(アムロジピンなど)にはミトコンドリア分裂抑制作用が見られなかったことから、シルニジピンは従来のカルシウム拮抗作用とは異なる薬理作用(Drp1-Filamin複合体抑制)を介してミトコンドリア異常分裂を抑制することが分かりました。そして、心筋梗塞モデルマウスにシルニジピンを投与することで心筋老化が抑制され、心機能が改善することを明らかにしました(図2)。
本研究により、心筋梗塞時に形成されるDrp1-Filamin複合体がミトコンドリア異常分裂を介して心筋細胞の早期老化現象を引き起こすことが明らかとなりました(図3)。今後、Drp1-Filamin複合体形成を阻害する薬が、新たな心不全治療法の開発に貢献するものと期待されます。
本研究は、国立研究開発法人科学技術振興機構(JST)・戦略的創造研究推進事業(さきがけ)の研究領域「疾患における代謝産物の解析および代謝制御に基づく革新的医療基盤技術の創出」における研究開発課題「硫黄循環・代謝を基軸とした生体レドックス恒常性制御基盤の構築」、科学研究費補助金、文部科学省新学術領域研究「酸素生物学」、国立研究開発法人日本医療研究開発機構(AMED)創薬等ライフサイエンス研究支援基盤事業「創薬等先端技術支援プラットフォーム(BINDS)」、臨床薬理研究振興財団の支援を受けて行われました。
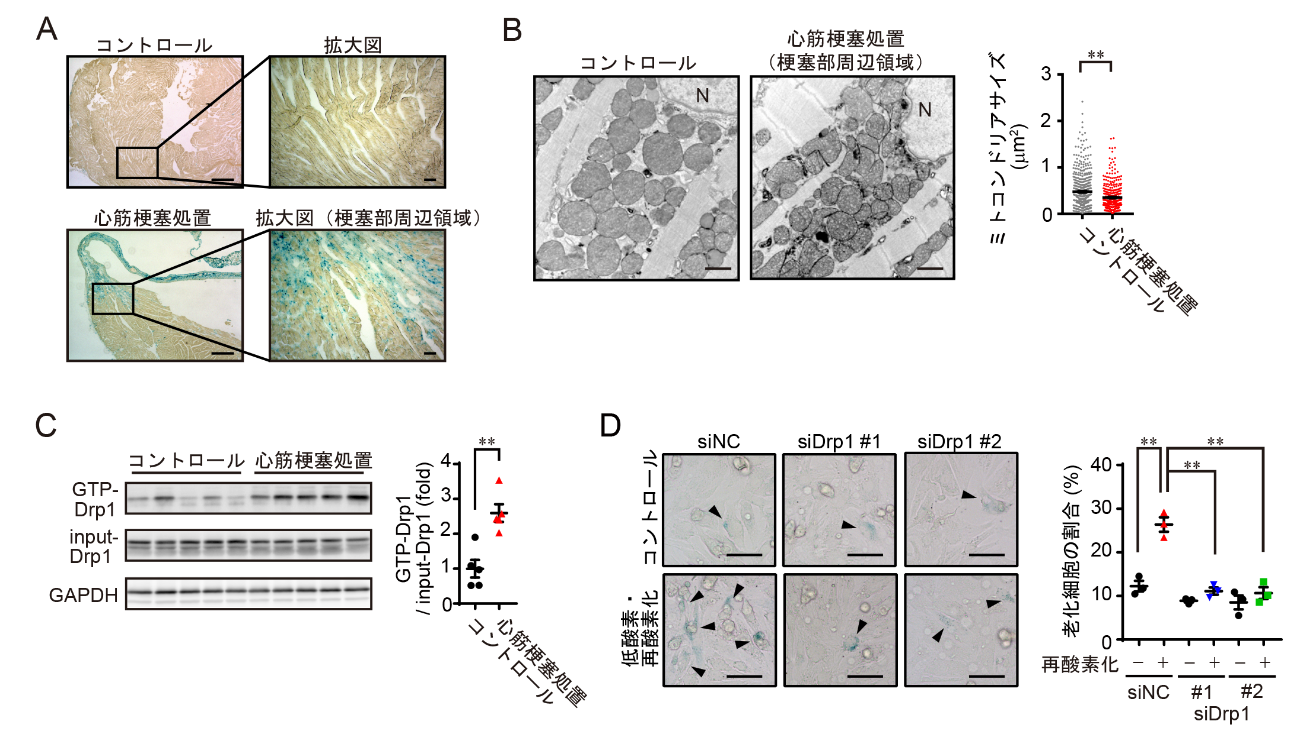
(A)コントロールマウスと心筋梗塞処置マウスの心臓における心筋細胞の早期老化。心筋梗塞処置マウスの梗塞部周辺領域ではSA-β-gal陽性(青色)の老化細胞が顕著に増加している。(B)コントロールマウスと心筋梗塞処置マウスの心臓における心筋ミトコンドリア形態の電子顕微鏡図。右図はミトコンドリアサイズを定量化したもの。(C)コントロールマウスと心筋梗塞処置マウスの心臓におけるDrp1の活性化。(D)心筋細胞老化におけるDrp1の役割。ラット胎児心筋細胞にコントロールsiRNA (siNC)、Drp1 siRNA (siDrp1 #1, #2)を導入した後、低酸素・再酸素化刺激を行うことで細胞老化を誘導した。右図は老化細胞の割合を定量化したもの。
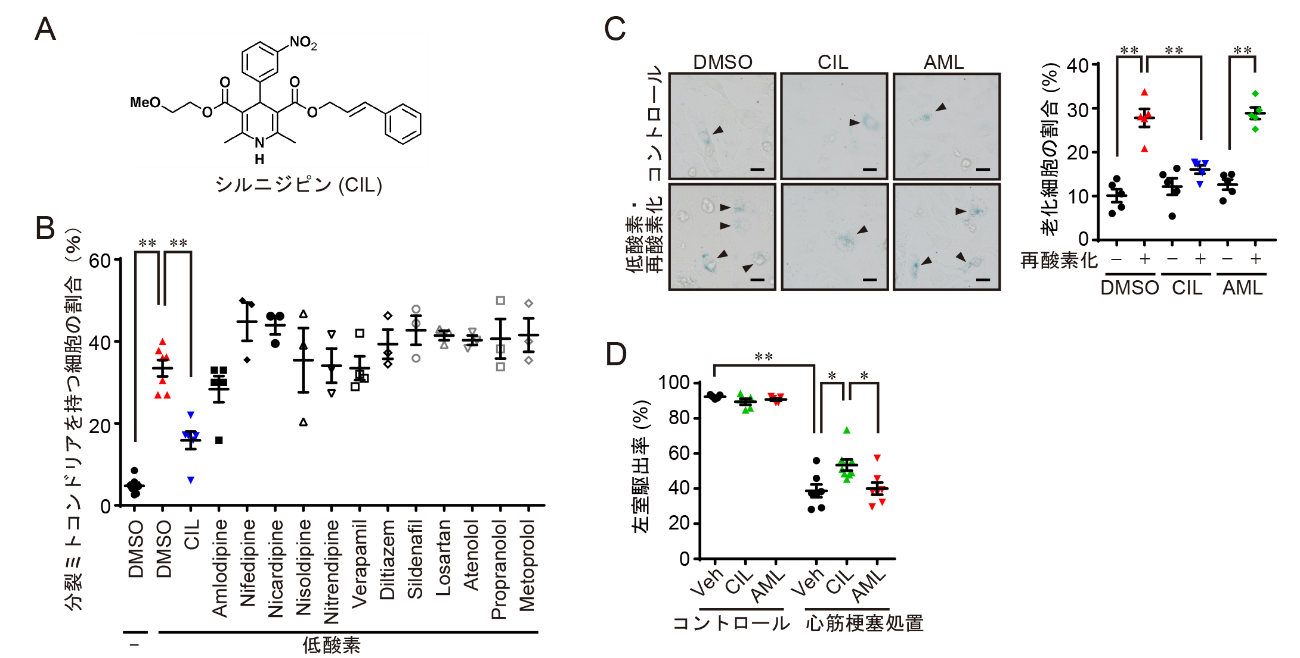
(A)シルニジピン(CIL)の構造。(B)低酸素依存性ミトコンドリア分裂を抑制する化合物のスクリーニング。高血圧症治療薬の中でシルニジピンだけが低酸素依存性のミトコンドリア分裂を抑制した。(C)心筋細胞老化に対するシルニジピンの効果。ラット胎児心筋細胞をシルニジピン(CIL)もしくはアムロジピン(AML)で処理した後、低酸素・再酸素化刺激により心筋老化を誘導した。右図は老化細胞の割合を定量化したもの。(D)シルニジピンによる心筋梗塞後の心機能改善効果。心筋梗塞処置1週間後のマウスにVehicle (Veh)、シルニジピン(CIL)もしくはアムロジピン(AML)を投与し、4週間後の左室駆出率(心機能の指標)を測定した。
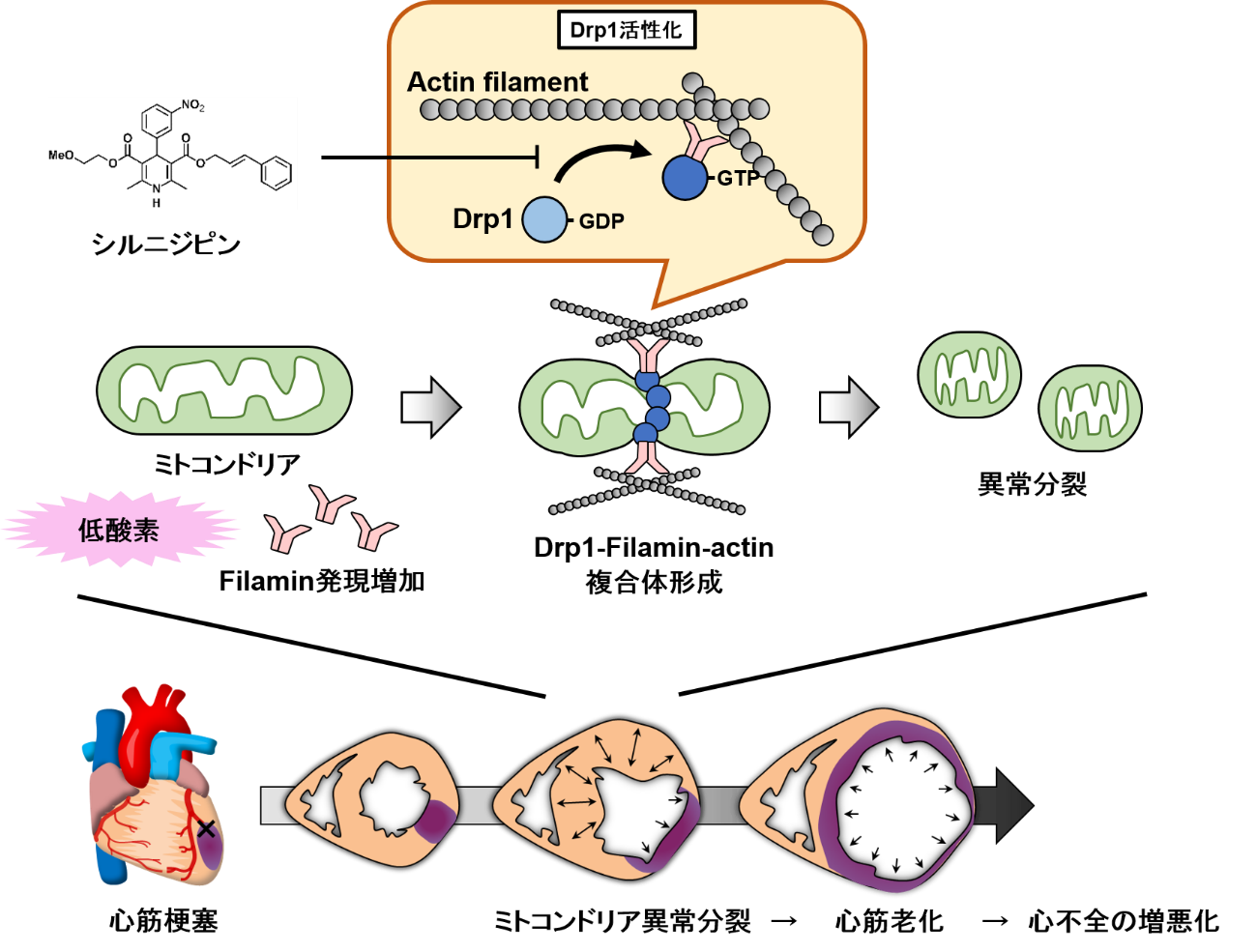
心筋梗塞初期において、低酸素刺激依存的にFilaminとDrp1が複合体を形成することでDrp1が活性化し、ミトコンドリア分裂が起こる。ミトコンドリア分裂により誘導される心筋細胞の早期老化現象は、心筋の収縮力を低下させることで心不全を進行させる。シルニジピンはDrp1-Filamin複合体形成を阻害することで心機能低下を抑制する。
ミトコンドリアの機能異常は心不全だけでなく、様々な難治性疾患でも報告されており、新たな創薬標的として注目されています。今回、同定したシルニジピンのミトコンドリア保護作用を今後詳しく調べていくことで、ミトコンドリア機能保護をコンセプトにした新薬の開発が期待されます。
Nishimura A, Shimauchi T, Tanaka T, Shimoda K, Toyama T, Kitajima N, Ishikawa T, Shindo N, Numaga-Tomita T, Yasuda S, Sato Y, Kuwahara K, Kumagai Y, Akaike T, Ide T, Ojida A, Mori Y, Nishida M.
Hypoxia-induced interaction of filamin with Drp1 causes mitochondrial hyperfission-associated myocardial senescence. Science Signaling (日本時間2018年11月14日午前4時掲載).
<研究について>
大学共同利用機関法人 自然科学研究機構 生理学研究所
心循環シグナル研究部門
国立大学法人 九州大学 大学院薬学研究院 創薬育薬研究施設統括室
教授 西田 基宏(ニシダ モトヒロ)
<広報に関すること>
大学共同利用機関法人 自然科学研究機構 生理学研究所
研究力強化戦略室
大学共同利用機関法人 自然科学研究機構 生命創成探究センター
広報担当
国立大学法人 九州大学 広報室
Science | AAAS
<AMED事業に関すること>
国立研究開発法人 日本医療研究開発機構(AMED)
創薬戦略部 医薬品研究課





自然科学研究機構 生理学研究所 研究力強化戦略室
自然科学研究機構 生命創成探究センター
国立大学法人 九州大学
国立研究開発法人 日本医療研究開発機構
Science Signaling | AAAS