安藤 潤(自然科学研究機構分子科学研究所 助教)
中村 彰彦(自然科学研究機構分子科学研究所 助教)
アカシット ビストサット(総合研究大学院大学 博士後期課程 学生)
山本 真由子(自然科学研究機構分子科学研究所 技術支援員)
ソン チホン(自然科学研究機構生理学研究所 特任助教)
村田 和義(自然科学研究機構生理学研究所 准教授)
飯野 亮太(自然科学研究機構分子科学研究所 教授)
・光学顕微鏡1分子観察の目印である金ナノ粒子の位置決定精度※1をオングストローム(100億分の1メートル)レベルに向上させ、原子レベルの微小な動きの追跡を可能にした
・金ナノ粒子からの信号光強度を高める輪帯照明型の全反射暗視野顕微鏡※2を構築し、原子レベル位置決定精度かつマイクロ秒オーダーの時間分解能を達成した
・細胞の物質輸送に関わるモータータンパク質、キネシン※3が2足歩行する様子を観察し、足の動きを10マイクロ秒間隔で詳細に追跡することに成功した
・本技術により、モータータンパク質※4が効率的に働く仕組みの解明など、生物学、化学分野への様々な貢献が期待される
金ナノ粒子は、モータータンパク質などの生体分子が働く様子を、光学顕微鏡で1分子観察するための目印(プローブ)として用いられています。金ナノ粒子は光を強く散乱するため(図1A)、マイクロ秒の時間分解能での高速1分子観察に用いられてきましたが、粒子の位置をどこまで正確に決めることができるのか(位置決定精度)、その原理的限界は明らかになっていませんでした。
分子科学研究所および生理学研究所の研究グループは、光学顕微鏡による金ナノ粒子の観察における位置決定精度の原理的な限界を解明し、原子レベルの位置決定精度を達成することに成功しました。また、金ナノ粒子からの信号光強度を高める輪帯照明型の全反射暗視野顕微鏡を構築し、マイクロ秒オーダーの時間分解能と原子レベルの位置決定精度を両立しました。さらに開発した装置を用いて、生体内の長距離物質輸送を担うモータータンパク質キネシンの挙動を観察し、キネシンの足の動きを10マイクロ秒の時間分解能で詳細に追跡することに成功しました。本成果により、モータータンパク質が効率的に働く仕組みの解明など、生物学分野への様々な貢献が期待されます。
光学顕微鏡は、タンパク質や脂質などの生体分子が働く様子を、ありのままに捉えることができます。目的の生体分子に蛍光色素などの目印(プローブ)を付けることで、分子1つ1つの動きを調べることができます。蛍光色素をプローブとして用いた1分子計測法は、生物物理学やバイオフォトニクスの研究分野で大きく発展しています。
光学顕微鏡で1分子計測を行うと、目印をつけた個々の分子が約100ナノメートル(nm, 10億分の1メートル)の輝点として捉えられます(図1B)。大きさ数nmの生体分子よりも輝点が1桁から2桁程度大きくなるのは、光学顕微鏡の空間分解能※5が、用いる光の波長の半分程度に制限されるためです。しかし、輝点の中心位置を決める精度(位置決定精度)は、空間分解能の制限より遥かに良い値を示します(図1 C, D)。位置決定精度は理論的には、検出される光子の数(フォトン数)の平方根に比例して向上するとされています。例えば蛍光分子では1万フォトン程度が得られ、ナノメートルレベルの位置決定精度とミリ秒(1000分の1秒)オーダーの時間分解能を達成できます。
さらに、画像を連続的に撮影すれば動画が得られ、各画像の中心座標を取得すれば、生体分子の動きを高精度に追跡できます。高精度化・高速化がさらに進めば、生体分子が働く仕組みの理解は一層深まります。しかし、蛍光分子から得られるフォトン数に限りがあること、蛍光分子が発光しなくなる現象(褪色)が生じることから、さらなる向上は困難でした。
この困難を改善するため最近は、蛍光色素の代わりに金ナノ粒子が目印として用いられ始めています。金ナノ粒子は、緑色の光と共鳴し、光を強く散乱します(図1A)。蛍光プローブと比較して圧倒的に高い信号光強度が得られ、褪色も起こりません。これまでに、マイクロ秒(100万分の1秒)オーダーの時間分解能での観察が達成されていますが、金ナノ粒子の位置決定精度の原理的な限界は分かっていませんでした。
分子研および生理研の研究グループは、独自に開発した輪帯照明型の全反射暗視野顕微鏡を用いて、粒径40 nmの金ナノ粒子を、1.3オングストローム(Å, 100億分の1メートル)の位置決定精度、1ミリ秒の時間分解能で観察することに成功しました(図2上)。また、33マイクロ秒の時間分解能においても、5.4 Åの位置決定精度を達成しました。
まず、位置決定精度の下限値を決める要素を特定するため、入射光強度や粒径を変えて計測を行いました。その結果、位置決定精度は、フォトン数の平方根に比例して向上することを確認しました。この結果は、位置決定精度を定める理論式とよく一致します。さらに、従来の全反射暗視野顕微鏡の位置決定精度の下限値が約3 Åであり、検出器の信号の飽和が下限値を決めることを見いだしました。検証結果に基づき、位置決定精度の向上を図るため、輪帯照明型の全反射暗視野顕微鏡を開発しました。輪帯照明とすることで、これまで対物レンズの1点に集光していたレーザー光を円状に分散できます。これにより対物レンズの光損傷を抑え、入射可能な光強度を高めることを可能にしました。さらに、検出器のピクセルサイズを小さくすることで、信号の飽和を抑制しました。これらの改良により、位置決定精度の下限値を1.3 Åまで向上させることに成功しました。
また、位置決定精度と時間分解能の関係についても検証しました。モータータンパク質の動作は、エネルギーを得るための化学反応がミリ秒、化学反応を引き金とした機械的な運動がミリ秒以下の時間スケールで進行します。モータータンパク質が動く仕組みを理解するには、高い位置決定精度と共に、高い時間分解能が必要になります。しかし、時間分解能と位置決定精度はトレードオフの関係にあります。時間分解能が高いほど、画像1フレームで得られるフォトン数が低下し、位置決定精度が低下するためです。今回開発した装置は、入射光強度を高めることができるため、高速、かつ高精度な計測を実現できます。実際に、33 μsの時間分解能で5.4 Åの位置決定精度を達成しました。
次に、金ナノ粒子の粒径と位置決定精度の関係についても検証しました。金ナノ粒子にかかる慣性力や水の粘性抵抗は、モータータンパク質の動きを阻害しない程度に十分小さいことが確認されていますが、さらに粒径を下げることができれば、生体分子の動きを妨げる可能性をより低減できます。しかし、粒径と位置決定精度もトレードオフの関係にあり、粒径の低下に伴って散乱強度が非線形に減少してしまいます。直径20から40 nmの金ナノ粒子を計測して比較した結果、散乱強度が粒径の4乗に比例して大きく変化することを確認しました。しかし、開発した顕微鏡装置では入射光強度を高めることで微小な粒子からも強い散乱光を得られ、粒径30 nmでも1.9 Åの位置決定精度を達成することができました(図2下)。
さらに、開発した高位置決定精度かつ高速な1分子計測法を用い、キネシンが微小管上を歩行する様子を観察しました(図3)。キネシンの片方の足に直径40 nmの金ナノ粒子を結合し、10 μsの時間分解能で足の動きを詳細に観察しました。先行研究では、微小管から外れた足は進行方向に対して右側で揺らぐ(ブラウン運動する)ことが明らかとなっており、キネシンは一方向に回転しながら直進する可能性が示唆されていました。今回、さらに高い時間分解能で観察することで、微小管に結合している足が離れる瞬間の動きが明らかになりました。足が離れる際、進行方向に対し左側に向かう動きがみられなかったことから、キネシンは確かに回転しながら直進していると結論しました。
モータータンパク質をはじめとする生体分子機械の多くは、複数の部品(サブユニット)で構成されています。そして複数の構成部品が協調しながら直進運動や回転運動を行うことで、高度な機能を発揮します。本研究成果により、生体分子機械の微細で精巧な作動原理に、原子レベルの位置決定精度で挑むことが可能になりました。実際、我々のグループでは最近、キチン加水分解酵素が結晶性多糖の脱結晶化と加水分解を行いながら1 nmずつ直進運動する仕組みを明らかにしています。今後も、生物学分野におけるより広範な応用が期待されます。さらに本技術は、生体分子機械よりもずっと小さな人工分子機械の原子レベルの動きの可視化にも有用と考えられ、化学分野における応用も期待されます。
※1: 位置決定精度:
光学顕微鏡で得られる輝点の中心座標を決定する精度の尺度。連続撮像した粒子の光学像の重心位置を解析し、その標準偏差から算出する。
※2: 全反射暗視野顕微鏡:
ガラスと水の界面で光を全反射させ、界面近傍に局在するエバネッセント光を用いて試料を照明する顕微鏡。試料から発生した散乱光を検出して光学像を得る。
※3: キネシン
細胞の輸送機能に関わるモータータンパク質。細胞内に張り巡らされた微小管と呼ばれるレールに沿って直進運動する。まるでヒトが歩くように、2つの足を交互に前に踏み出しながら前進する。それぞれの足の部分に、エネルギー源となるATPを分解する機能と、微小管との結合・解離を制御する機能が備わっている。
※4: モータータンパク質
化学エネルギー等を機械的な一方向性運動に変換するタンパク質(生体分子モーター)の総称。ATPを分解しながら直進運動するキネシンやダイニン、回転運動するF-ATPaseやV-ATPase、結晶性の基質を分解しながら直進するキチナーゼなどがある。
※5: 光学顕微鏡の空間分解能
観察対象となる2つの物質(蛍光分子や金ナノ粒子)が、光学像においてどの程度近づくと区別できなくなるかを示す指標。光の回折により、光学像は実際の分子のスケールよりも広がって(ぼけて)しまう。
掲載誌:Biophysical Journal
論文タイトル(和訳):
Single-nanoparticle tracking with angstrom localization precision and microsecond time resolution
(オングストローム位置決定精度とマイクロ秒時間分解能による単一ナノ粒子の追跡)
著者(全員):
Jun Ando†, Akihiko Nakamura†, Akasit Visootsat, Mayuko Yamamoto, Chihong Song, Kazuyoshi Murata, Ryota Iino*(†共同筆頭著者、*責任著者)
ウェブ掲載日:2018年11月16日(東部時間)
DOI: https://doi.org/10.1016/j.bpj.2018.11.016
分子科学研究所、生理学研究所
科学研究費補助金JP18H05424, JP18H02418, JP18H04755, JP17K19213(飯野亮太)
科学研究費補助金JP18H01904 (安藤潤)
自然科学研究機構新分野創成センター イメージングサイエンス研究分野プロジェクトIS291003 (安藤潤)
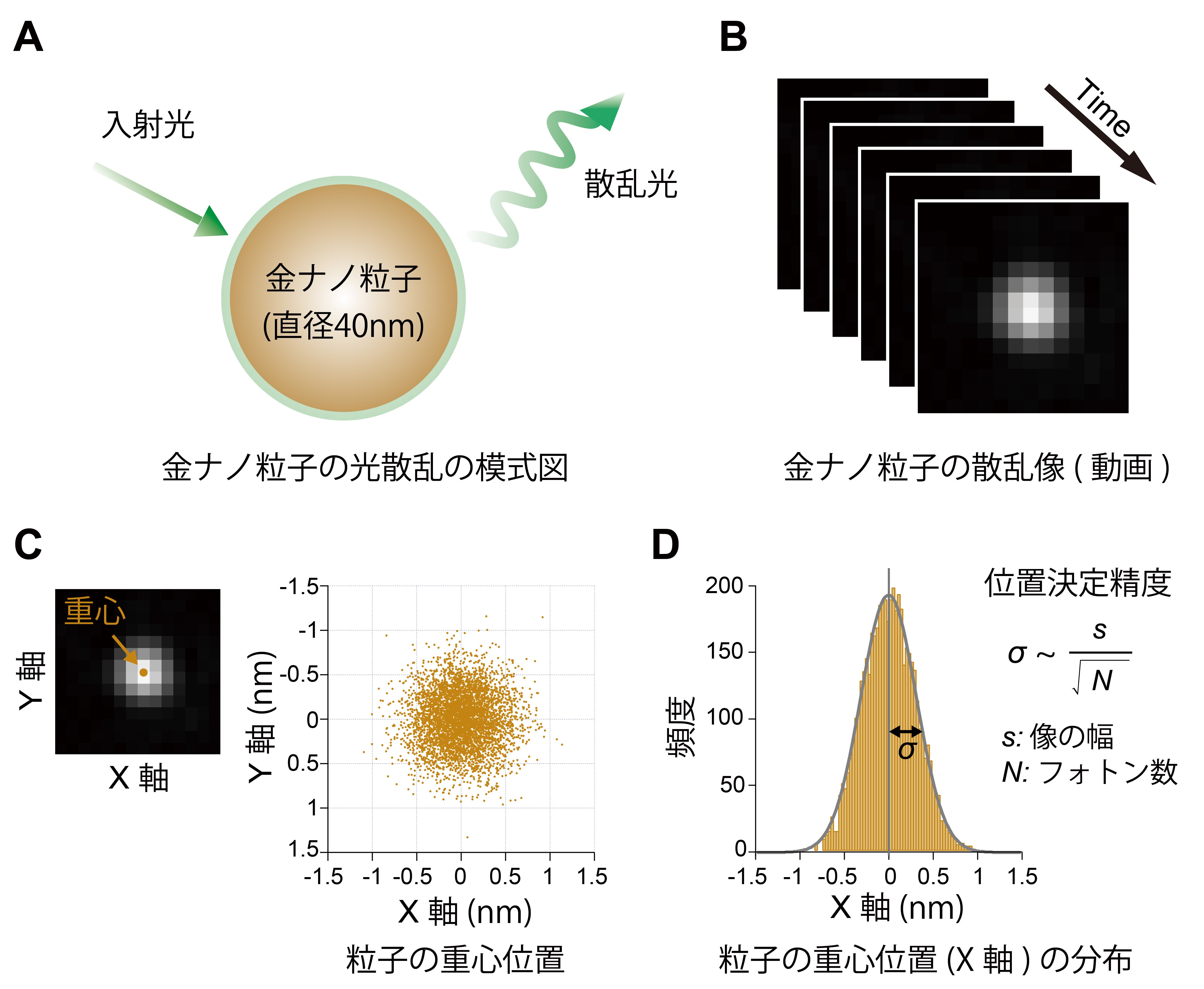
(A) 金ナノ粒子による光散乱の模式図。
(B) 連続撮像した金ナノ粒子の散乱像。
(C) 散乱像の重心位置の2次元プロット。
(D) 粒子のX軸の重心位置の分布。標準偏差から位置決定精度が算出される。
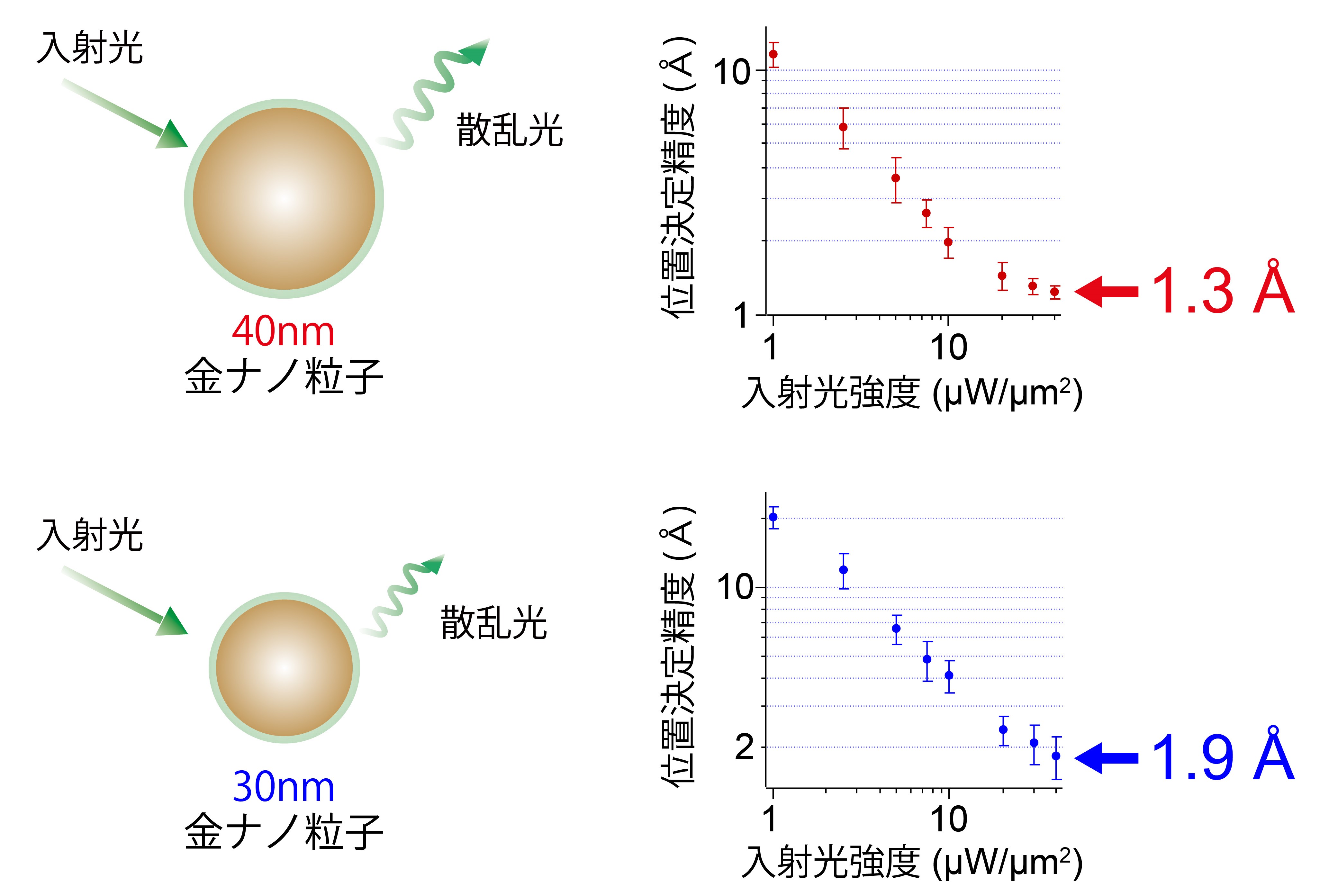
(上) 直径40nmの場合。位置決定精度の下限値は1.3 Å。
(下) 直径30nmの場合。位置決定精度の下限値は1.9 Å。
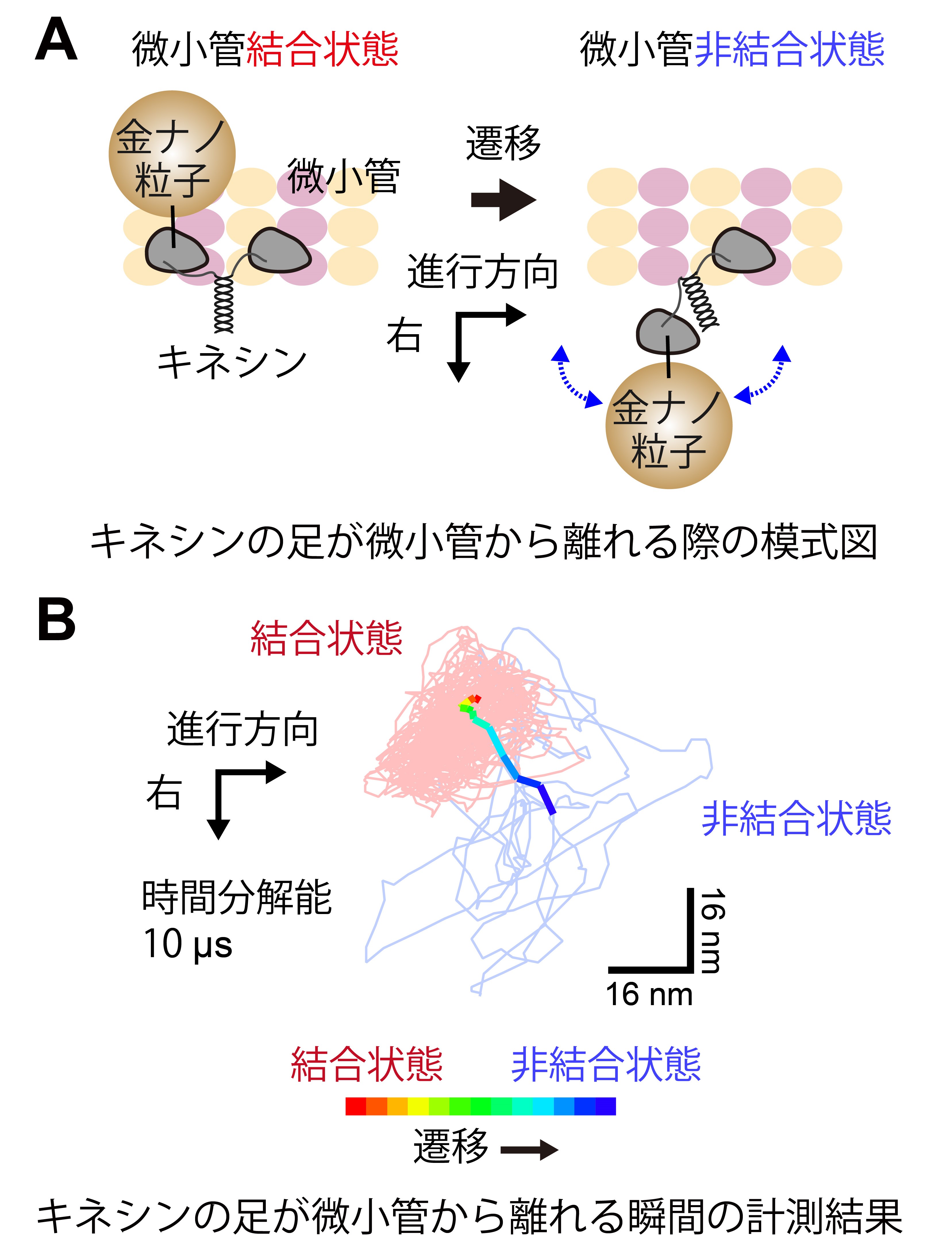
(A) キネシンの片足が微小管から離れる前後の模式図。
(B) 微小管に結合していた片足が離れる瞬間の金ナノ粒子の動き。進行方向に対して右側に向かって、非結合状態へと遷移している(虹色で表示)。10μsの時間分解能で撮像。
自然科学研究機構分子科学研究所
教授 飯野 亮太(いいの りょうた)
TEL:0564-59-5232 FAX:0564-59-5231
E-mail:iino@ims.ac.jp
https://groups.ims.ac.jp/organization/iino_g/
自然科学研究機構 分子科学研究所 研究力強化戦略室 広報担当


自然科学研究機構 分子科学研究所
自然科学研究機構 生理学研究所研究所