内容
ヒトの脳内では様々な神経伝達物質が協調して働くことで、記憶や情動など様々な脳機能を制御しています。それらの神経伝達物質の中でも、ドーパミンとノルエピネフリンは類似した化学構造を持ち、多くの脳機能において互いに関与しあっていると考えられています。そのため、いつどこでどれくらいドーパミンとノルエピネフリン(ノルアドレナリンとも言います)が放出されているかを調べることは、複雑な脳機能の解明に必須です。しかし、ドーパミンとノルエピネフリンは構造的に非常に類似しているため、それらを生体内で特異的に、かつ高い感度並びに高い時間的・空間的分解能で観察することは困難でした。
今回、基礎生物学研究所 定量生物学研究部門/生命創成探究センター 定量生物学研究グループの後藤祐平助教、青木一洋教授、デンマーク オーフス大学の中本千尋博士研究員、竹内倫徳准教授らは、生理学研究所の深田正紀教授ら、デンマーク コペンハーゲン大学のGloriam教授らとの共同研究により、赤色蛍光タンパク質を用いたドーパミンバイオセンサー「R-GenGAR-DA」の開発に成功しました。この赤色蛍光ドーパミンセンサーのドーパミンに対する高い選択性を利用し、既報の緑色蛍光ノルエピネフリンバイオセンサーと共に用いることで、ひとつの細胞でドーパミンとノルエピネフリンを同時に可視化することに成功しました。
本成果は、英国の学術誌「Molecular Brain」に2021年12月06日付けで発表されました。
研究の背景
ヒトをはじめとした動物の脳内では多くの神経細胞が複雑に協調して働き、記憶や情動、運動機能など様々な脳機能を制御しています。神経細胞同士のシグナル伝達には、グルタミン酸、GABA、ドーパミンやノルエピネフリン等の神経伝達物質が使われています。それぞれの神経細胞がこれらの物質を放出し、受け手側の神経細胞が受容体によってこれらの物質を感知することで、情報の伝達がおこなわれています(図1)。
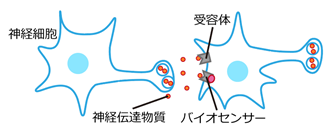 図1:
図1:神経細胞による情報の伝達の概念図。神経細胞から放出された神経伝達物質は、受け手側の神経細胞の発現する受容体によって受容されることで情報が伝達されます。神経細胞にバイオセンサーを発現させることにより、放出された神経伝達物質を可視化することが可能となります。
それらの神経伝達物質の中でも、ドーパミンとノルエピネフリンは類似した化学構造を持ち、多くの脳機能において互いに協調しあって働いていると考えられています。そのため、いつどの場所でどれくらいドーパミンとノルエピネフリンが神経細胞から放出されているかを計測することは、複雑な脳機能の解明に必須です。しかし、ドーパミンとノルエピネフリンは構造的に非常に類似しているため、それらを生体内で特異的に、かつ高い感度並びに高い時間的・空間的分解能で観察することは技術的に困難でした。
そこで、本研究グループは、蛍光タンパク質を使ったバイオセンサーに着目しました。蛍光タンパク質を使ったバイオセンサーは、時間的・空間的な分解能が高く、いくつかの神経伝達物質の検出法として近年盛んに開発されるようになってきました。このバイオセンサーは、神経伝達物質の受容体(Gタンパク質共役型受容体)に蛍光タンパク質を融合したもので、神経伝達物質を受容した際の受容体の構造変化を蛍光タンパク質の蛍光輝度の変化へと変換します。このバイオセンサーを任意の神経細胞に発現させることで、神経細胞外のドーパミンとノルエピネフリンを高い時間的・空間的な分解能で、同時に可視化することができると考えました。
しかし、ドーパミンとノルエピネフリンを同時に可視化するためには、2つの問題がありました。1つ目は、既存のドーパミンバイオセンサーとノルエピネフリンバイオセンサーは緑色蛍光タンパク質をもとに作製されているため、ドーパミンとノルエピネフリンを区別して可視化することができません。2つ目は、ドーパミンとノルエピネフリンの化学構造が類似しているため、既存のドーパミンバイオセンサーはある程度ノルエピネフリンにも反応してしまうことが知られています。そこで、既存の緑色蛍光ノルエピネフリンバイオセンサーと同時可視化可能なドーパミンに対して高い選択性を持つ赤色蛍光ドーパミンバイオセンサーの開発に着手しました。
研究の成果
本研究では、まずはじめに、赤色蛍光でドーパミンを観察可能なバイオセンサーのスクリーニングを行いました。5種類あるヒトのドーパミン受容体のうちDRD1とよばれる受容体を骨格として、細胞内のシグナル伝達分子との結合に関与する細胞内側3番目ループ(ICL3)を赤色蛍光タンパク質の円順列変異体であるcpmAppleに置き換えました(図2左)。DRD1がドーパミンを受容すると、受容体の構造が変化しICL3にその構造変化が伝わります。挿入されたcpmAppleはその構造変化により蛍光輝度が変化するため、細胞外のドーパミン濃度に応じて蛍光輝度が変化するバイオセンサーとなります。研究グループは、この赤色蛍光ドーパミンバイオセンサーを「Red Genetically encoded GPCR Activation Reporter for DA (R-GenGAR-DA)」と名付けました。構造変化を蛍光輝度変化に効率よく変換するためには、DRD1とcpmAppleを接続するリンカー部位のアミノ酸配列が重要となります。そこで、リンカー部位にランダムな変異を導入して、ドーパミンによる蛍光輝度変化が大きくなる変異体をスクリーニングしました。800種類近くの変異体ライブラリーを作製し、一つ一つの変異体のドーパミンへの応答性をイメージングによって調べました。その結果として、もっともドーパミンへの応答性が大きかった変異体を「R-GenGAR-DA-1.1」と名付けました(図2右)。
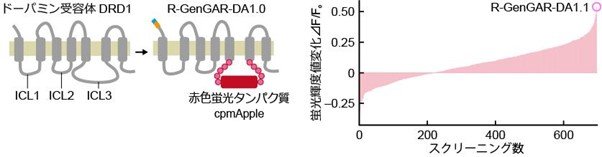 図2.
図2. 赤色蛍光ドーパミンバイオセンサーの作製戦略。(図左)ヒト・ドーパミン受容体DRD1をもとにして、細胞内側3番目ループ(ICL3)に赤色蛍光タンパク質の円順列変異体であるcpmAppleを挿入します。ドーパミンが結合してDRD1の構造が変化すると、cpmAppleの蛍光輝度が変化します。(図右)リンカー部位にランダム変異を入れて蛍光輝度値変化が大きい変異体をスクリーニングしました。
R-GenGAR-DA-1.1はノルエピネフリンと比較してドーパミンに対する特異性があまり高くなかったため(13倍程度)、更にバイオセンサーの最適化を行いました。具体的にはR-GenGAR-DA-1.1のドーパミン結合部位、DRD1の保存された領域やリンカー部位周辺に、アミノ酸の置換あるいは挿入を行いました。その結果、リンカー部位N末端にグルタミンを挿入した変異体「R-GenGAR-DA-1.2」がセンサーとして優れた性質を持っていることを発見しました(図3左)。R-GenGAR-DA-1.2は、ドーパミン投与により蛍光輝度が減少し(図3右)、ドーパミン濃度に応じて蛍光輝度減少量が変化します。また、ドーパミンへの選択性がノルエピネフリンと比較して66倍と高く(図3左下)、生体内でもドーパミンとノルエピネフリンを見分けることができると期待されました。
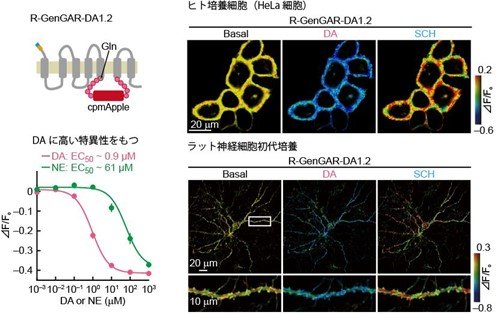 図3.
図3. リンカー部位に変異を導入したR-GenGAR1.2はドーパミンに対して高い特異性を持ちます。(図左)R-GenGAR1.2の模式図(上)。R-GenGAR1.2は、ノルエピネフリン(NE)と比較してドーパミンに対する特異性が高かった(下)。(図右)R-GenGAR-DA1.2を発現させたヒト培養細胞(上)、およびラット神経初代培養細胞(下)にドーパミン(DA)刺激をした後、DRD1の阻害剤(SCH)を投与しました。蛍光輝度の変化を疑似カラーで表示しています。
最後に、R-GenGAR-DA-1.2は高いドーパミンへの選択性を示したので、既存のノルエピネフリンに対して高い選択性を示す緑色蛍光ノルエピネフリンバイオセンサー(GRABNE1m, Feng et al.,2019, Neuron)と同時に用いることで、一つの細胞でドーパミンとノルエピネフリンを可視化できるかを検証しました。R-GenGAR-DA-1.2とGRABNE1mを共発現させたHeLa細胞、およびラットの初代神経培養細胞を用意し、ドーパミンとノルエピネフリンをそれぞれ投与しました。多重蛍光イメージング法を用いて赤色蛍光と緑色蛍光の増減を観察することで、ドーパミンとノルエピネフリンが投与されていることをそれぞれ独立に一つの細胞で観察することに成功しました(図4)。
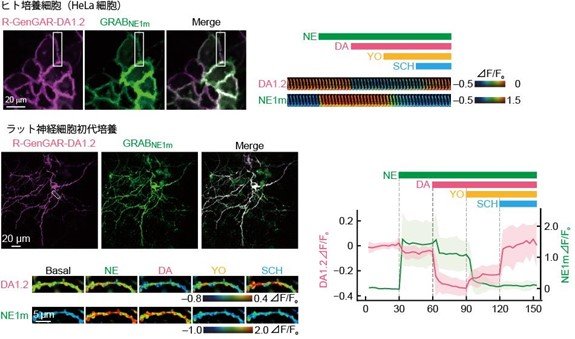 図4.
図4. ドーパミンとノルエピネフリンの多重蛍光イメージング。(図上)R-GenGAR-DA-1.2とGRABNE1mを発現させたHeLa細胞。ノルエピネフリン(NE)、ドーパミン(DA)、α2アドレナリン受容体の阻害剤(YO)、DRD1の阻害剤(SCH)を順番に投与しました。右図の画像は、左図の四角で囲った領域におけるそれぞれのバイオセンサーの蛍光輝度変化を疑似カラーで表しました。(図下) R-GenGAR-DA-1.2とGRABNE1mを発現させたラット神経初代培養細胞。ノルエピネフリン(NE)、ドーパミン(DA)、α2アドレナリン受容体の阻害剤(YO)、DRD1の阻害剤(SCH)を順番に投与しました。右図のグラフは、左図の四角で囲った領域におけるそれぞれのバイオセンサーの蛍光輝度変化を表しています。
本研究の課題と今後の展望
本研究では、ドーパミンに対する選択性の高い新規赤色蛍光ドーパミンバイオセンサー「R-GenGAR1.2」を作製し、既報のノルエピネフリンに対して高い選択性を示す緑色蛍光ノルエピネフリンバイオセンサーと組み合わせることで、ドーパミンとノルエピネフリンを区別して可視化することに成功しました。しかし、この赤色蛍光ドーパミンバイオセンサーを用いて、動物個体内でドーパミンをイメージングするためには、さらなる改良が必要です。
発表雑誌
雑誌名 Molecular Brain
掲載日 2021年12月06日
論文タイトル:A novel red fluorescence dopamine biosensor selectively detects dopamine in the presence of norepinephrine in vitro
著者:Chihiro Nakamoto*, Yuhei Goto*, Yoko Tomizawa, Yuko Fukata, Masaki Fukata, Kasper Harpsøe, David E. Gloriam, Kazuhiro Aoki**, Tomonori Takeuchi**
(*co-first authors, **co-corresponding authors)
DOI:https://doi.org/10.1186/s13041-021-00882-8
研究グループ
本研究は、基礎生物学研究所/生命創成探究センターの青木 一洋教授のグループ、デンマーク オーフス大学の竹内倫徳准教授のグループ、生理学研究所の深田正紀教授のグループ、デンマーク コペンハーゲン大学のGloriam教授のグループの共同研究で行われました。
研究サポート
本研究は、下記の補助金による支援を受けて実施されました。
日本学術振興会科研費・若手研究(19K16050:後藤祐平)
日本学術振興会科研費・基盤研究(B)(18H02444:青木一洋)
日本学術振興会科研費・新学術領域研究「情報物理学でひもとく生命の秩序と設計原理」(19H05798:青木一洋)
科学技術振興機構CREST(JPMJCR1654:青木一洋)
本研究に関するお問い合わせ
基礎生物学研究所 定量生物学研究部門
生命創成探究センター 定量生物学研究グループ
教授 青木 一洋 (アオキ カズヒロ)
准教授 竹内 倫徳 (タケウチ トモノリ)
Department of Biomedicine, Aarhus University
報道担当
基礎生物学研究所 広報室
自然科学研究機構 生命創成探究センター 研究連携推進室
生理学研究所 研究力強化戦略室
リリース元



自然科学研究機構 基礎生物学研究所
自然科学研究機構 生命創成探究センター
自然科学研究機構 生理学研究所
554
 図1:神経細胞による情報の伝達の概念図。神経細胞から放出された神経伝達物質は、受け手側の神経細胞の発現する受容体によって受容されることで情報が伝達されます。神経細胞にバイオセンサーを発現させることにより、放出された神経伝達物質を可視化することが可能となります。
図1:神経細胞による情報の伝達の概念図。神経細胞から放出された神経伝達物質は、受け手側の神経細胞の発現する受容体によって受容されることで情報が伝達されます。神経細胞にバイオセンサーを発現させることにより、放出された神経伝達物質を可視化することが可能となります。 図2. 赤色蛍光ドーパミンバイオセンサーの作製戦略。(図左)ヒト・ドーパミン受容体DRD1をもとにして、細胞内側3番目ループ(ICL3)に赤色蛍光タンパク質の円順列変異体であるcpmAppleを挿入します。ドーパミンが結合してDRD1の構造が変化すると、cpmAppleの蛍光輝度が変化します。(図右)リンカー部位にランダム変異を入れて蛍光輝度値変化が大きい変異体をスクリーニングしました。
図2. 赤色蛍光ドーパミンバイオセンサーの作製戦略。(図左)ヒト・ドーパミン受容体DRD1をもとにして、細胞内側3番目ループ(ICL3)に赤色蛍光タンパク質の円順列変異体であるcpmAppleを挿入します。ドーパミンが結合してDRD1の構造が変化すると、cpmAppleの蛍光輝度が変化します。(図右)リンカー部位にランダム変異を入れて蛍光輝度値変化が大きい変異体をスクリーニングしました。
 図4. ドーパミンとノルエピネフリンの多重蛍光イメージング。(図上)R-GenGAR-DA-1.2とGRABNE1mを発現させたHeLa細胞。ノルエピネフリン(NE)、ドーパミン(DA)、α2アドレナリン受容体の阻害剤(YO)、DRD1の阻害剤(SCH)を順番に投与しました。右図の画像は、左図の四角で囲った領域におけるそれぞれのバイオセンサーの蛍光輝度変化を疑似カラーで表しました。(図下) R-GenGAR-DA-1.2とGRABNE1mを発現させたラット神経初代培養細胞。ノルエピネフリン(NE)、ドーパミン(DA)、α2アドレナリン受容体の阻害剤(YO)、DRD1の阻害剤(SCH)を順番に投与しました。右図のグラフは、左図の四角で囲った領域におけるそれぞれのバイオセンサーの蛍光輝度変化を表しています。
図4. ドーパミンとノルエピネフリンの多重蛍光イメージング。(図上)R-GenGAR-DA-1.2とGRABNE1mを発現させたHeLa細胞。ノルエピネフリン(NE)、ドーパミン(DA)、α2アドレナリン受容体の阻害剤(YO)、DRD1の阻害剤(SCH)を順番に投与しました。右図の画像は、左図の四角で囲った領域におけるそれぞれのバイオセンサーの蛍光輝度変化を疑似カラーで表しました。(図下) R-GenGAR-DA-1.2とGRABNE1mを発現させたラット神経初代培養細胞。ノルエピネフリン(NE)、ドーパミン(DA)、α2アドレナリン受容体の阻害剤(YO)、DRD1の阻害剤(SCH)を順番に投与しました。右図のグラフは、左図の四角で囲った領域におけるそれぞれのバイオセンサーの蛍光輝度変化を表しています。

