概要
山梨大学大学院総合研究部医学域薬理学講座 小泉修一教授及び篠崎陽一准教授の研究チームは、これまで原因が分からなかった正常眼圧緑内障の発症に関わる分子を発見しました。研究はロンドン大学(UCL)眼科学研究所のルング・アレックスさん(大学院生)及び大沼信一教授との国際共同研究です。また、東京都医学総合研究所 原田高幸参事研究員、生理学研究所超微形態研究部門/自治医科大学解剖学講座 大野伸彦教授、新潟大学大学院医歯学総合研究科脳機能形態学分野 竹林浩秀教授、山梨大学大学院総合研究部眼科学講座 柏木賢治教授、同学 総合分析実験センター 瀬川高弘講師、社会医学講座 三宅邦夫准教授らが協力しました。
緑内障は眼圧が異常に高くなる事で発症する疾患と考えられていましたが、実際には眼圧が正常範囲内のいわゆる「正常眼圧緑内障
[1]」の患者数が圧倒的に多い事が知られています。研究チームは、世界中の緑内障患者を対象としたGWAS
[2]と呼ばれる遺伝子変異解析のデータベースから、「ATP-binding cassette transporter A1 (ABCA1)
[3]」の異常を見いだし、この分子に注目した解析を始めました。マウスを使った実験により、ABCA1が網膜や視神経周囲に存在する「グリア細胞
[4]」と呼ばれる細胞群のうち、「アストロサイト
[5]」に存在している事、このABCA1の機能が損なわれると眼圧が正常にもかかわらず網膜の神経細胞が傷害され正常眼圧緑内障様の症状を引き起こす事、を発見しました。また、「1細胞RNAシークエンス
[6]」による解析から、アストロサイトは「ケモカイン
[7]」を産生する事や、グルタミン酸受容体サブタイプ「NR3A
[8]」を持つ神経細胞が選択的に傷害を受ける事を明らかにしました。これらは世界で初めてアストロサイトが緑内障の新たな治療標的となる可能性を示す成果です。本研究成果は米国科学振興協会(AAAS)が刊行するオープンアクセス誌Science Advancesに掲載されます。
論文情報
論文タイトル
Astrocytic dysfunction induced by ABCA1 deficiency causes optic neuropathy
著者
#Youichi Shinozaki, #Alex Leung, Kazuhiko Namekata, Sei Saitoh, Huy Bang Nguyen, Akiko Takeda, Yosuke Danjo, Yosuke M Morizawa, Eiji Shigetomi, Fumikazu Sano, Nozomu Yoshioka, Hirohide Takebayashi, Nobuhiko Ohno, Takahiro Segawa, Kunio Miyake, Kenji Kashiwagi, Takayuki Harada, Shin-ichi Ohnuma*, and Schuichi Koizumi*
#共同筆頭著者、*責任著者
掲載誌
Science Advances誌
[2022年11月5日3時(日本時間)/2022年11月4日(米国東部標準時)に掲載されます]
DOI: 10.1126/sciadv.abq1081
背景
緑内障は、日本における中途失明原因第一位の疾患です。有病率は40歳以上で約5%と言われており、その割合は加齢に伴いさらに上昇します。緑内障における失明は、視覚情報を脳へ伝達する網膜神経節細胞(RGC)の障害によって引き起こされると考えられています。緑内障発症の最大のリスク因子の1つとして、眼圧があります。眼圧が上昇する事により、視神経が傷害されやすくなると考えられています。従って、緑内障の進行を遅らせるための治療として眼圧を下げる処置がとられます。既に複数の眼圧を下げる点眼薬が治療に用いられていますが、単一の薬剤では効果が不十分な場合がある事、薬剤の効果が徐々に減弱する場合がある事、眼圧を十分に下降させても症状が進行してしまう場合がある事のほか、様々な副作用などの問題がありました。また、日本人の緑内障患者の多くは眼圧が正常値である正常眼圧緑内障に相当するため、眼圧以外の新たな治療標的の探索が喫緊の課題になっていました。
緑内障は、加齢、人種、喫煙、高血圧、糖尿病、家族歴などの様々な危険因子が影響する多因子疾患です。危険因子の1つとして遺伝的要因があります。遺伝的要因と疾患の発症のしやすさを調べる研究であるGWASにより、ABCA1遺伝子の一塩基多型と緑内障発症リスクに相関がある事が明らかとなっています。従って、ABCA1が何らかの形で緑内障発症に関わる事は推察されますが、①ABCA1機能の欠損または異常な機能の獲得のどちらが大事なのか、②緑内障リスクとして最も良く知られる眼圧に影響するのか否か、③ABCA1は眼のどの細胞に発現して緑内障に寄与するのか、などメカニズムについてはほとんど明らかになっていませんでした。
研究成果
研究チームはまず、ABCA1機能の欠損または異常な機能の獲得のどちらが緑内障発症と関わるのかについて検討を行いました。この事を明らかにするため、ABCA1を全身性に欠損するマウス(ABCA1KOマウス)を用いて、RGCへの影響を調べました。その結果、正常なマウス(野生型マウス)に比べて、ABCA1KOマウスの網膜では、12カ月齢においてRGCの数が有意に減少する事を発見しました (図1A)。また、細胞死を起こしている細胞を標識してみると、野生型マウスに比べてABCA1KOマウスの網膜では、細胞死を起こしているRGC数が有意に増えていました(図1B)。次に、ABCA1KOマウスの眼圧が変化するかを評価したところ、野生型マウスの眼圧と比べて顕著な上昇は見られませんでした(図2)。これらの結果より、ABCA1の機能欠損が眼圧の上昇とは独立に緑内障発症に寄与する可能性が考えられました。
次に、研究チームはABCA1がどの細胞に発現するのかを様々な手法を用いて評価しました。その結果ABCA1は、網膜最内層および視神経に分布する非神経細胞であるグリア細胞の1種であるアストロサイトに豊富に発現する事を発見しました(図3)。アストロサイトに発現するABCA1を欠損するマウス(AstroKO)を作出して評価を行ったところ、AstroKOマウスでも12カ月齢でコントロールマウス(Ctr)に比べてRGC数が有意に減少(図4A)し、死細胞数が増加(図4B)しました。また、AstroKOマウスの眼圧は、Ctrマウスと比べて顕著な上昇を示しませんでした(図5)。これらの結果から、研究チームはAstroKOマウスが正常緑内障様の症状を示すのではないかと考え、緑内障を特徴づける解剖学的・機能的所見を評価しました。12カ月齢のAstroKOマウスは、野生型マウスに比べて顕著に網膜内層の菲薄化を示し(図6A)、多局所網電図による視覚応答が顕著に減弱していました(図6B)。以上の結果より、AstroKOマウスは正常眼圧緑内障様の症状を示す事が明らかになりました。
更に分子メカニズムを明らかにするため、研究チームは1細胞RNAシークエンスによる解析を行いました(図7A)。その結果、ケモカインと呼ばれる分子がRGCとアストロサイトで共通して変化する事を見出しました(図7B, 7C)。網膜内での発現を見てみると、例えばCXCL12 (CXCR4を活性化するケモカイン)がアストロサイトに発現し、それがAstroKOマウスでは顕著に増加していました(図7D)。一方、RGCの詳細な解析から、特定の細胞集団が特に傷害を受けやすい事を発見しました。RGCは、1細胞解析から2つの亜集団に分類できました(図8A)。興味深い事に、ABCA1を欠損するとRGC-1と名付けた亜集団のみが特異的に減少する事が分かりました(図8B)。RGC-1の遺伝子発現変化を詳細に解析すると、イオンチャネル型グルタミン酸受容体サブユニットの1つであるGrin3a(NR3Aをコードする遺伝子)の発現がABCA1欠損で大きく減少していました(図8C)。NR3Aはグルタミン酸による神経興奮を抑制するため、その発現低下は過剰な神経興奮と興奮毒性による神経細胞死をもたらすものと考えられました。
今後の展開
今回の結果は、世界で初めて網膜や視神経に存在するアストロサイトが緑内障、特に正常眼圧緑内障の発症の原因となる可能性を実験的に示したものです。これまで、眼圧を下げる治療薬に注目が集まっていましたが、新しい治療標的としてアストロサイトを見出す事ができました。今後、アストロサイトの機能を制御する新たな緑内障治療薬の開発が期待されます。
本研究は、文部科学省の科学研究費補助金・学術変革領域研究(A)、基盤研究(A)、国際共同研究強化(A)、基盤研究(B)、基盤研究(C)、挑戦的研究(開拓)、研究拠点形成事業、先端バイオイメージング支援プラットフォーム(ABiS)、山梨GLIAセンター研究助成、公益財団法人 武田科学振興財団、高齢者眼疾患研究財団、及び第一三共生命科学研究振興財団による支援を受けて行われました。
図1. ABCA1KOマウスにおけるRGCの脱落と細胞死
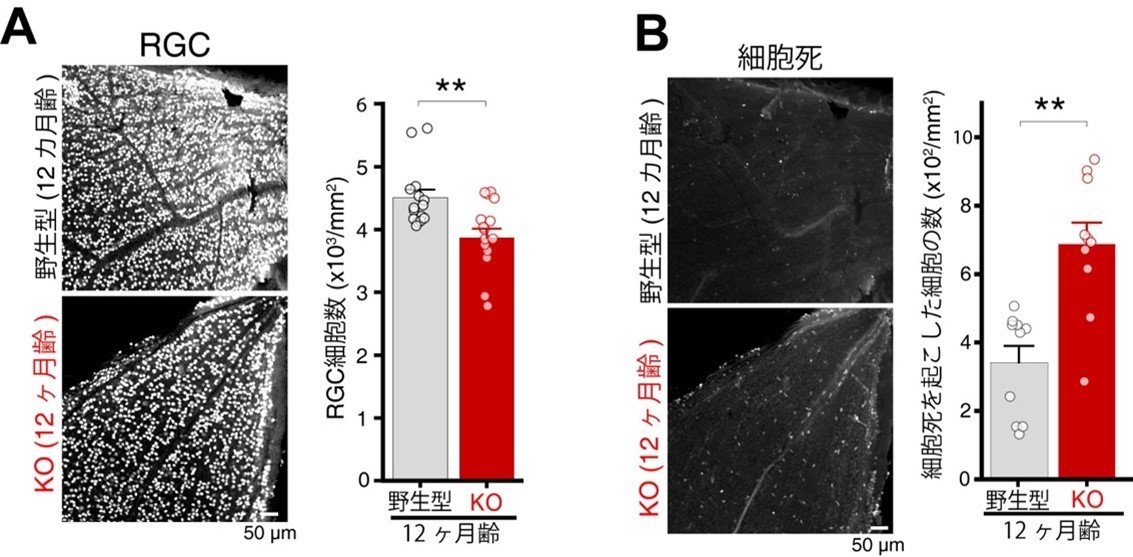
(A)12カ月齢マウス網膜のRGC数を計測したところ、野生型マウスに比べてABCA1KOマウスではRGC数が有意に減少していました(**は有意差を示します)。(B)一方、細胞死を検出する染色で評価を行うと、ABCA1KOで細胞死を起こした細胞の数が有意に増加していました。
図2. ABCA1KOは眼圧に影響しない
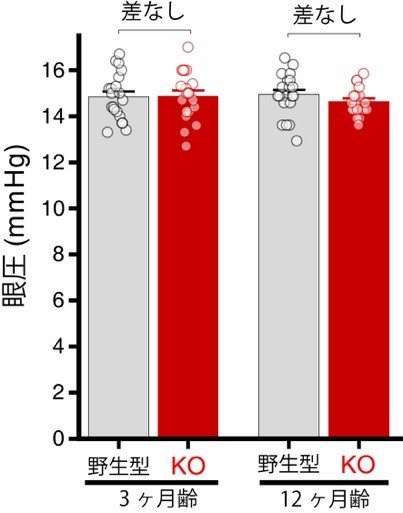
3カ月齢および12カ月齢の野生型とABCA1KOマウスの眼圧を比較したところ、いずれの月齢でも両者に有意な差はなく、ABCA1の欠損は眼圧に大きな影響は及ぼさないと考えられました。
図3. ABCA1は網膜アストロサイトに発現する
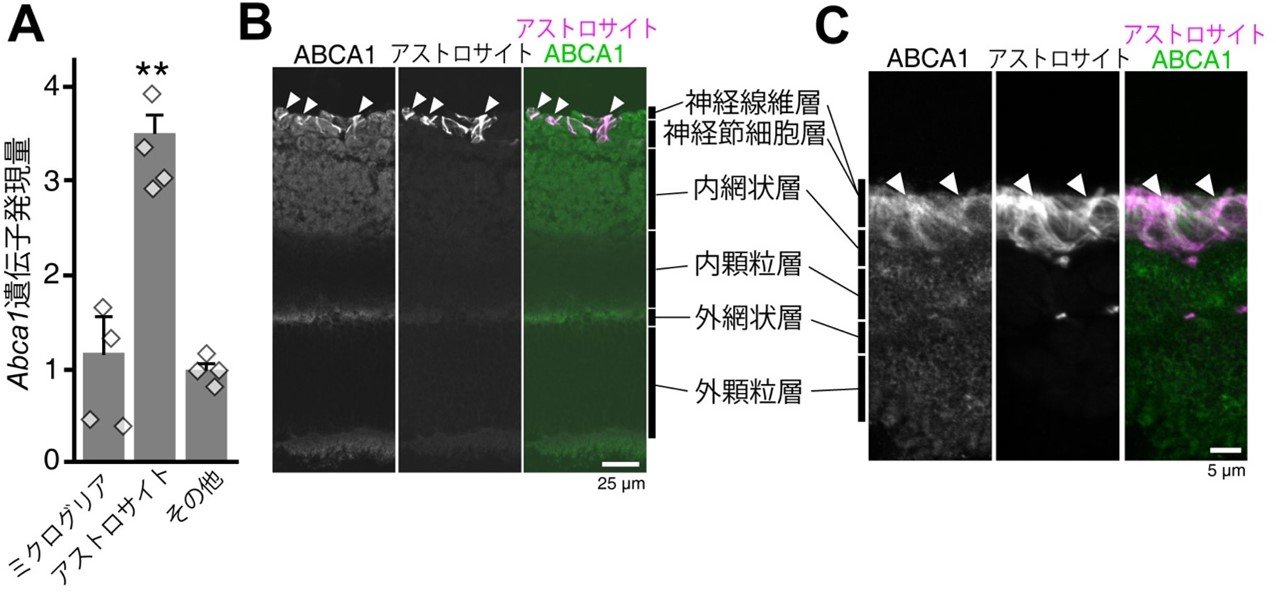
(A) 網膜の細胞をミクログリア、アストロサイト、その他(神経細胞や血管など)に分け、それぞれの分画でのAbca1遺伝子の発現量を評価したところ、アストロサイト画分での発現が他の分画に比べて3.5倍程度高い事が明らかとなりました。(B)免疫組織化学染色法でマウス網膜切片におけるABCA1の発現を評価したところ、神経線維層に強いシグナルが、内網状層や外網状層に弱いシグナルが認められました。強いシグナルはアストロサイトに高発現するタンパク質と共局在した事から、ABCA1は主にアストロサイトに発現する事が分かりました。(C)このような発現パターンは、ヒト網膜切片でも同様で、神経線維層~神経節細胞層にかけて強く発現し、主にアストロサイトに発現する事が明らかになりました。
図4. AstroKOマウスにおけるRGC脱落と細胞死
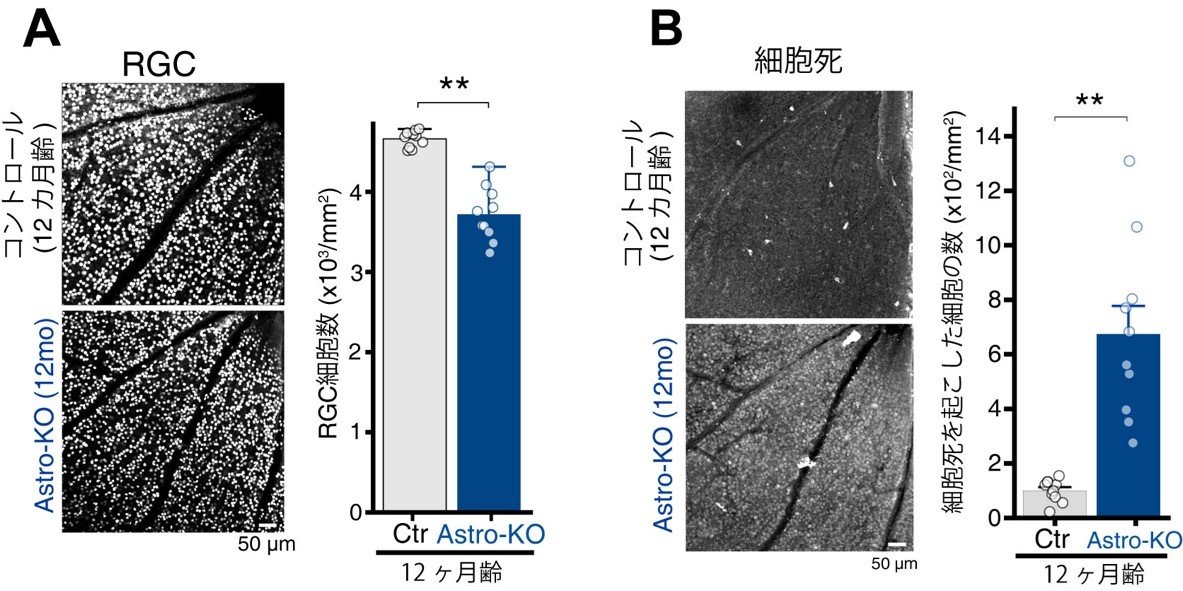
アストロサイトのABCA1を欠損したマウス(AstroKO)では、12カ月齢においてコントロール(Ctr, ABCA1を正常に発現する)マウスに比べて(A)RGCの細胞数が有意に減少し、(B)死細胞数が増加しました。
図5. アストロサイトのABCA1を欠損しても眼圧に影響しない
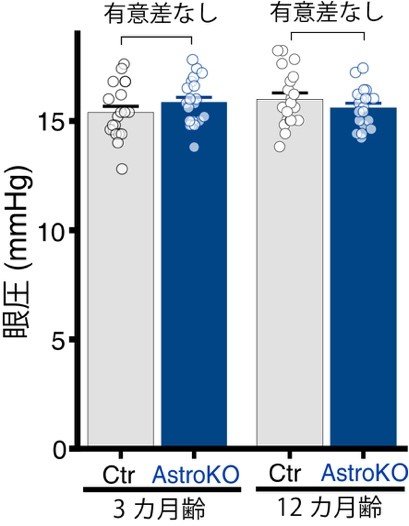
3カ月齢および12カ月齢のコントロールとAstroKOマウスの眼圧を比較したところ、いずれの月齢でも両者に有意な差はなく、アストロサイトにおけるABCA1の欠損は眼圧に大きな影響は及ぼさないと考えられました。
図6. AstroKOマウスは緑内障様症状を示す
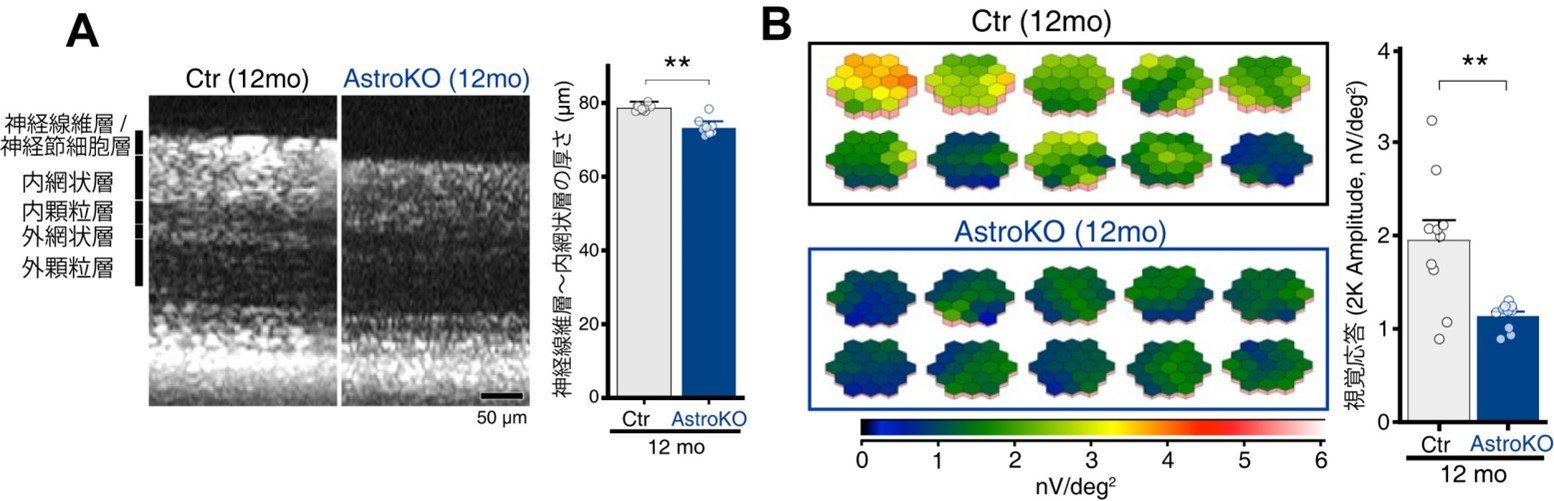
(A) 麻酔下で光干渉断層計を用いて網膜断層像を観察したところ、12カ月齢のAstroKOマウスは同月齢のCtrマウスに比べて網膜内層(神経線維層~内網状層)菲薄化が生じていました。(B)視覚機能を評価するため、多局所網膜電図にて視覚入力に対する電気的な応答を計測したところ、Abca1KOマウスでは顕著に応答が減弱していました。
図7. 1細胞RNAシークエンス解析
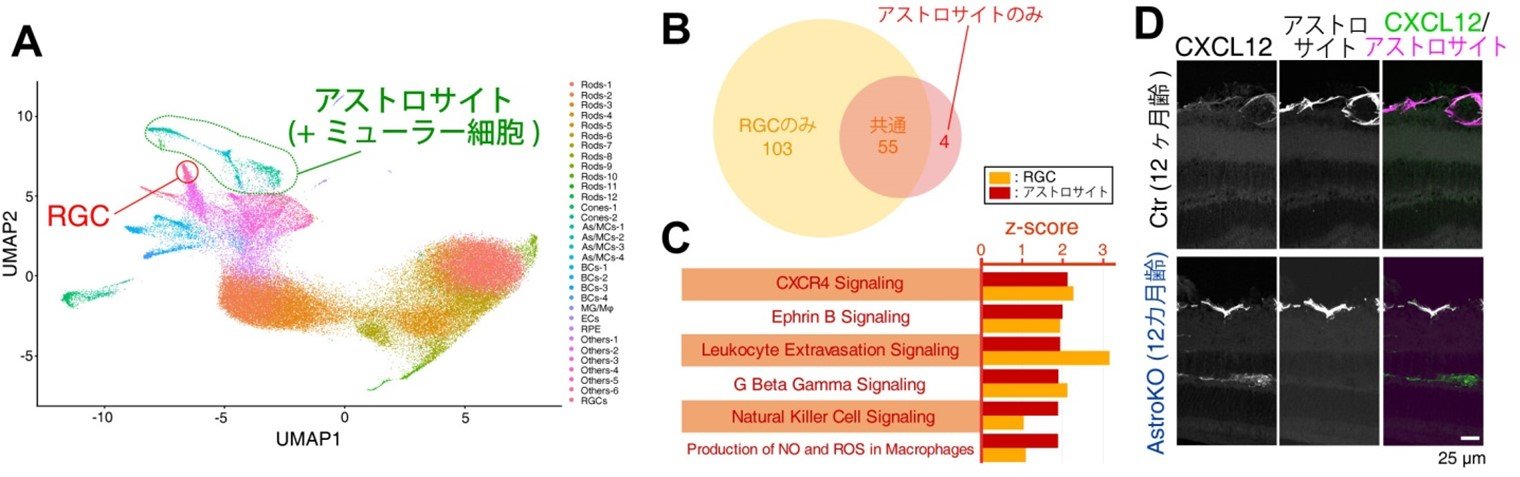
(A) 1細胞RNAシークエンスの結果、それぞれの細胞集団に分離する事ができ、細胞種ごとに詳細な解析を行いました。(B)アストロサイトおよびRGCで変動が認められた遺伝子群の多くが共通するものでした。(C)アストロサイトとRGCで共通して発現が増加するものとしてケモカイン受容体であるCXCR4 signaling pathwayを見出しました。(D)CXCR4のリガンドであるCXCL12の発現パターンを調べてみるとアストロサイトに限局して発現しており、AstroKOマウスではさらに発現が増加していました。
図8. 一部のRGCサブタイプは緑内障による影響を受けやすい
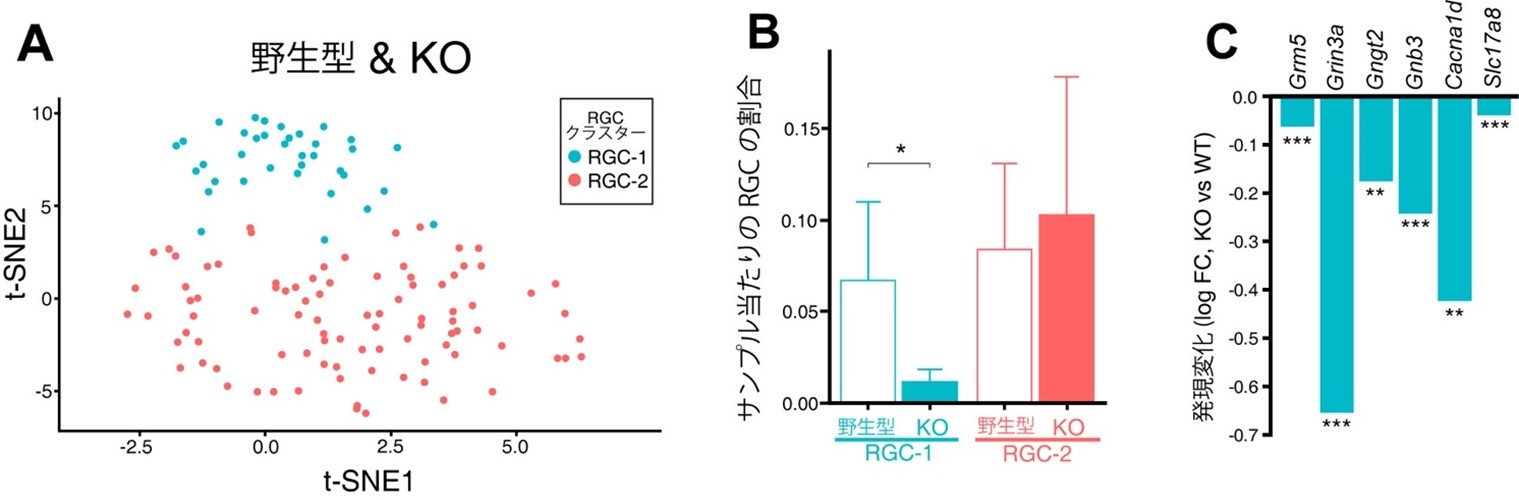
(A) 1細胞RNAシークエンスの結果、RGCは2つのサブクラスターに分類できる事が明らかになりました。(B)特に、RGC-1ではABCA1欠損に伴って特異的に細胞数が減少していました。(C)RGC-1では、ABCA1欠損によりGrin3a (NR3Aをコードする遺伝子)発現が顕著に減少していました。
図9. 本研究成果のまとめ
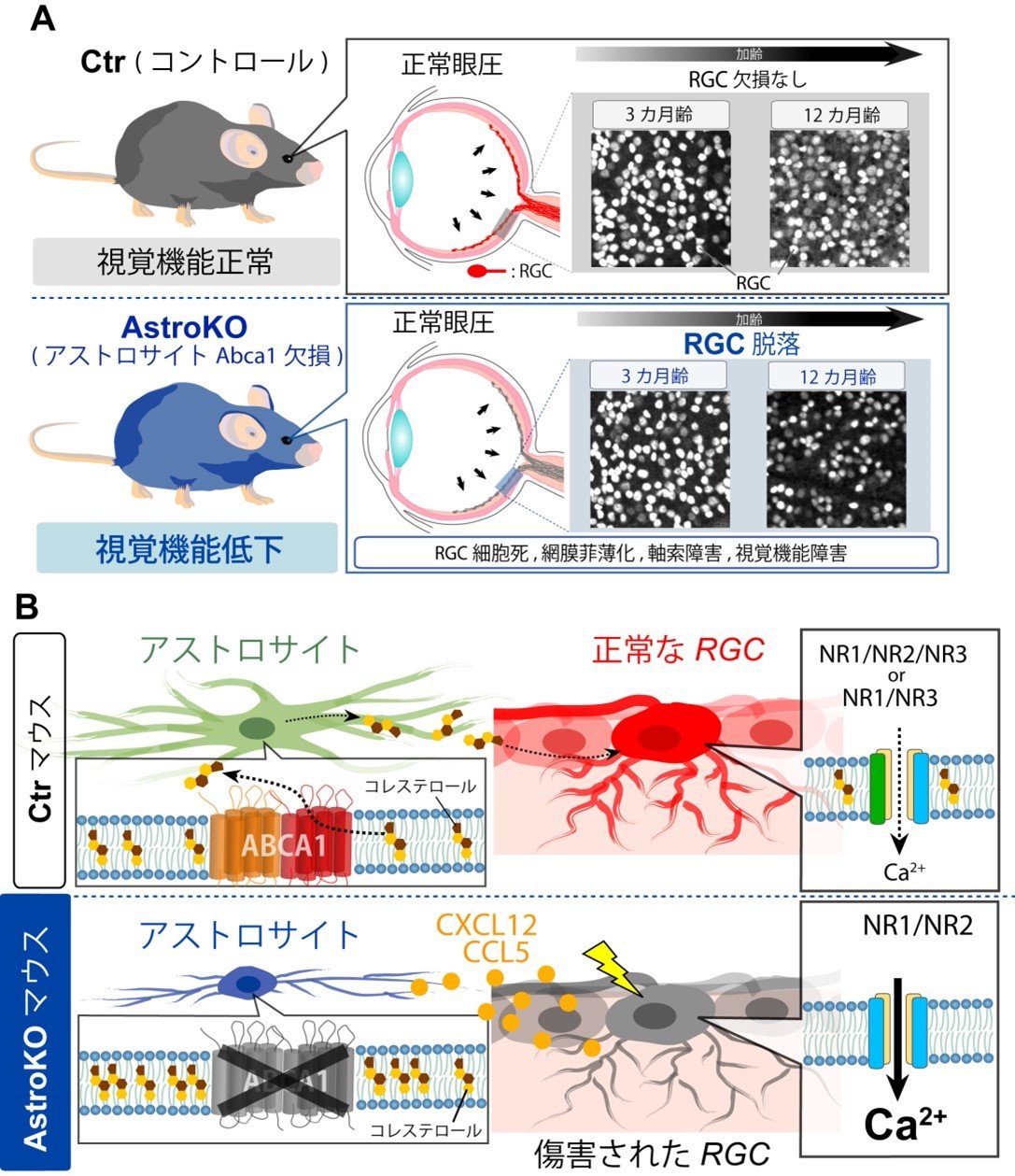
(A) アストロサイトABCA1欠損による緑内障様症状。AstroKOマウスは眼圧に変化は示さないものの、12カ月齢でRGCの脱落、網膜菲薄化、軸索障害や視覚機能障害など正常眼圧緑内障様症状を示します。(B) アストロサイトABCA1欠損による緑内障発症の分子メカニズム。ABCA1が欠損するとアストロサイト内にコレステロールが蓄積し、この事による細胞機能障害がアストロサイトからのケモカイン(CXCL12やCCL5など)の産生を誘導します。RGCのサブタイプはNR3Aを高発現しており、ABCA1欠損によってNR3Aの発現が低下します。これによってグルタミン酸によるシグナルが過剰となり、興奮毒性が生じてRGCの細胞死が誘導されると考えられました。
用語説明
[1] 正常眼圧緑内障
緑内障は、網膜神経節細胞(RGC)と呼ばれる網膜の神経細胞が傷害される事によって、次第に視野が欠損していく病気です。眼圧上昇が最も良く知られたリスク因子の1つですが、アジア人、特に日本人では緑内障患者であっても多くの方の眼圧が正常範囲内に収まる事から、眼圧以外の要因がこの病気の原因である可能性が考えられます。
[2] ゲノムワイド関連解析 (GWAS)
私たちの遺伝子はDNAの塩基配列(A, T, C, G)の組み合わせによってコードされていますが、同じ遺伝子をコードする配列でも人によって塩基のごく一部が異なる場合があります。これを一塩基多型(SNPs)と呼びますが、GWASはゲノム全体をカバーするほどの広い領域におけるSNPsの頻度を検出し、その頻度と疾患との関連性を統計学的に調べる方法です。この解析により、特定の遺伝子と疾患のリスクとの関係を推定します。
[3] ATP-binding cassette transporter (ABCA1)
ABC輸送体と呼ばれる膜タンパク質の1つです。ATPのエネルギーを用いて様々な化合物を細胞膜内外へと輸送します。ABCA1は、遊離脂肪酸やコレステロールなどの脂質を細胞外へと輸送してアポリポタンパクEなどに受け渡します。ABCA1はその他にも貪食作用、飲食作用、免疫細胞機能、開口放出、細胞内シグナル伝達、抗炎症作用など様々な機能を調節します。
[4] グリア細胞
脳などの中枢神経系を構成する細胞の1種です。ヒトでは神経細胞よりも数が豊富です。グリア細胞は、神経細胞のように電気生理的な興奮性を示さないので、静的で活動しない細胞と考えられて来ましたが、近年までの研究から非常に活発に活動している細胞である事が明らかとなっています。グリア細胞にはアストロサイト、ミクログリア、オリゴデンドロサイトなどが含まれます。
[5] アストロサイト
グリア細胞の1種です。最も大きく、数も多い細胞種です。これまでは脳内の支持及び恒常性維持の役割を担うと考えられてきましたが、最近は脳の情報処理にも積極的に関与する事が明らかとなっています。アストロサイトは網膜の最内層表面や視神経の周囲にも存在します。網膜実質内には、アストロサイトに似たミューラー細胞も存在します。
[6] 1細胞RNAシークエンス
1細胞RNAシークエンスは、網膜など組織内の細胞を1つ1つ分離して、それら1つの細胞が保持しているメッセンジャーRNAの状態や量を網羅的に調べる方法です。得られた量的情報をデジタル化し、情報学的に解析(バイオインフォマティクス)する事によって医学生物学的メカニズムを客観的かつ網羅的に解析する事ができます。
[7] ケモカイン
ケモカインは、サイトカインと呼ばれる細胞間情報伝達物質の1種で、塩基性タンパク質です。白血球などの遊走を引き起こし、炎症を惹起します。
[8] NR3A
NR3Aは、N-メチル-D-アスパラギン酸(NMDA)受容体を構成するサブユニットの1種です。NMDA受容体は、NR1及びNR2またはNR3サブユニットで構成され、イオンチャネルを形成します。生体内ではグルタミン酸が結合して活性化します。NR3はドミナントネガティブ型とも呼ばれ、イオンチャネルの活性を抑制します。
*研究チーム
山梨大学 大学院総合研究部 医学域 基礎医学系 薬理学講座/GLIAセンター
教授 小泉 修一 (責任著者)
准教授 篠崎 陽一 (共同筆頭著者)
大学院生 武田 明子
学部生 檀上 洋右
大学院生 森澤 陽介 (現 米国コロンビア大学ポスドク)
助教 佐野 史和
准教授 繁冨 英治
英国ロンドン大学 眼科学研究所 脳科学研究部門
教授 大沼 信一 (共同責任著者)
大学院生 ルング アレックス (共同筆頭著者)
東京都医学総合研究所 視覚病態プロジェクト
参事研究員 原田 高幸
副参事研究員 行方 和彦
生理学研究所 超微形態研究部門/自治医科大学 医学部 組織学部門
教授 大野 伸彦
研究員 グェン フイ バン
特任助教 齋藤 成 (現 藤田医科大学 医学部 解剖学II 講師)
新潟大学大学院 医歯学総合研究科 脳機能形態学分野
教授 竹林 浩秀
助教 吉岡 望
山梨大学 大学院総合研究部 医学域 臨床医学系 眼科学講座
教授 柏木 賢治
山梨大学 大学院総合研究部 総合分析実験センター
講師 瀬川 高弘
山梨大学 大学院総合研究部 医学域 基礎医学系 社会医学講座
准教授 三宅 邦夫
お問い合わせ先
<研究について>
国立大学法人山梨大学 大学院総合研究部 医学域 基礎医学系薬理学講座/GLIAセンター
教授 小泉 修一(コイズミ シュウイチ)
公益財団法人東京都医学総合研究所 視覚病態プロジェクト
参事研究員 原田 高幸(ハラダ タカユキ)
大学共同利用機関法人自然科学研究機構 生理学研究所 超微形態研究部門/
自治医科大学 医学部 組織学部門
教授 大野 伸彦(オオノ ノブヒコ)
国立大学法人新潟大学大学院 医歯学総合研究科 脳機能形態学分野
教授 竹林 浩秀 (タケバヤシ ヒロヒデ)
<広報に関すること>
国立大学法人山梨大学 企画部広報企画課
公益財団法人東京都医学総合研究所 事務局 研究推進課
大学共同利用機関法人自然科学研究機構 生理学研究所 研究力強化戦略室
学校法人自治医科大学 研究支援課
国立大学法人新潟大学 広報室
リリース元






山梨大学
ロンドン大学
東京都医学総合研究所
生理学研究所
自治医科大学
新潟大学
4524
 (A)12カ月齢マウス網膜のRGC数を計測したところ、野生型マウスに比べてABCA1KOマウスではRGC数が有意に減少していました(**は有意差を示します)。(B)一方、細胞死を検出する染色で評価を行うと、ABCA1KOで細胞死を起こした細胞の数が有意に増加していました。
(A)12カ月齢マウス網膜のRGC数を計測したところ、野生型マウスに比べてABCA1KOマウスではRGC数が有意に減少していました(**は有意差を示します)。(B)一方、細胞死を検出する染色で評価を行うと、ABCA1KOで細胞死を起こした細胞の数が有意に増加していました。 3カ月齢および12カ月齢の野生型とABCA1KOマウスの眼圧を比較したところ、いずれの月齢でも両者に有意な差はなく、ABCA1の欠損は眼圧に大きな影響は及ぼさないと考えられました。
3カ月齢および12カ月齢の野生型とABCA1KOマウスの眼圧を比較したところ、いずれの月齢でも両者に有意な差はなく、ABCA1の欠損は眼圧に大きな影響は及ぼさないと考えられました。 (A) 網膜の細胞をミクログリア、アストロサイト、その他(神経細胞や血管など)に分け、それぞれの分画でのAbca1遺伝子の発現量を評価したところ、アストロサイト画分での発現が他の分画に比べて3.5倍程度高い事が明らかとなりました。(B)免疫組織化学染色法でマウス網膜切片におけるABCA1の発現を評価したところ、神経線維層に強いシグナルが、内網状層や外網状層に弱いシグナルが認められました。強いシグナルはアストロサイトに高発現するタンパク質と共局在した事から、ABCA1は主にアストロサイトに発現する事が分かりました。(C)このような発現パターンは、ヒト網膜切片でも同様で、神経線維層~神経節細胞層にかけて強く発現し、主にアストロサイトに発現する事が明らかになりました。
(A) 網膜の細胞をミクログリア、アストロサイト、その他(神経細胞や血管など)に分け、それぞれの分画でのAbca1遺伝子の発現量を評価したところ、アストロサイト画分での発現が他の分画に比べて3.5倍程度高い事が明らかとなりました。(B)免疫組織化学染色法でマウス網膜切片におけるABCA1の発現を評価したところ、神経線維層に強いシグナルが、内網状層や外網状層に弱いシグナルが認められました。強いシグナルはアストロサイトに高発現するタンパク質と共局在した事から、ABCA1は主にアストロサイトに発現する事が分かりました。(C)このような発現パターンは、ヒト網膜切片でも同様で、神経線維層~神経節細胞層にかけて強く発現し、主にアストロサイトに発現する事が明らかになりました。 アストロサイトのABCA1を欠損したマウス(AstroKO)では、12カ月齢においてコントロール(Ctr, ABCA1を正常に発現する)マウスに比べて(A)RGCの細胞数が有意に減少し、(B)死細胞数が増加しました。
アストロサイトのABCA1を欠損したマウス(AstroKO)では、12カ月齢においてコントロール(Ctr, ABCA1を正常に発現する)マウスに比べて(A)RGCの細胞数が有意に減少し、(B)死細胞数が増加しました。 3カ月齢および12カ月齢のコントロールとAstroKOマウスの眼圧を比較したところ、いずれの月齢でも両者に有意な差はなく、アストロサイトにおけるABCA1の欠損は眼圧に大きな影響は及ぼさないと考えられました。
3カ月齢および12カ月齢のコントロールとAstroKOマウスの眼圧を比較したところ、いずれの月齢でも両者に有意な差はなく、アストロサイトにおけるABCA1の欠損は眼圧に大きな影響は及ぼさないと考えられました。 (A) 麻酔下で光干渉断層計を用いて網膜断層像を観察したところ、12カ月齢のAstroKOマウスは同月齢のCtrマウスに比べて網膜内層(神経線維層~内網状層)菲薄化が生じていました。(B)視覚機能を評価するため、多局所網膜電図にて視覚入力に対する電気的な応答を計測したところ、Abca1KOマウスでは顕著に応答が減弱していました。
(A) 麻酔下で光干渉断層計を用いて網膜断層像を観察したところ、12カ月齢のAstroKOマウスは同月齢のCtrマウスに比べて網膜内層(神経線維層~内網状層)菲薄化が生じていました。(B)視覚機能を評価するため、多局所網膜電図にて視覚入力に対する電気的な応答を計測したところ、Abca1KOマウスでは顕著に応答が減弱していました。 (A) 1細胞RNAシークエンスの結果、それぞれの細胞集団に分離する事ができ、細胞種ごとに詳細な解析を行いました。(B)アストロサイトおよびRGCで変動が認められた遺伝子群の多くが共通するものでした。(C)アストロサイトとRGCで共通して発現が増加するものとしてケモカイン受容体であるCXCR4 signaling pathwayを見出しました。(D)CXCR4のリガンドであるCXCL12の発現パターンを調べてみるとアストロサイトに限局して発現しており、AstroKOマウスではさらに発現が増加していました。
(A) 1細胞RNAシークエンスの結果、それぞれの細胞集団に分離する事ができ、細胞種ごとに詳細な解析を行いました。(B)アストロサイトおよびRGCで変動が認められた遺伝子群の多くが共通するものでした。(C)アストロサイトとRGCで共通して発現が増加するものとしてケモカイン受容体であるCXCR4 signaling pathwayを見出しました。(D)CXCR4のリガンドであるCXCL12の発現パターンを調べてみるとアストロサイトに限局して発現しており、AstroKOマウスではさらに発現が増加していました。 (A) 1細胞RNAシークエンスの結果、RGCは2つのサブクラスターに分類できる事が明らかになりました。(B)特に、RGC-1ではABCA1欠損に伴って特異的に細胞数が減少していました。(C)RGC-1では、ABCA1欠損によりGrin3a (NR3Aをコードする遺伝子)発現が顕著に減少していました。
(A) 1細胞RNAシークエンスの結果、RGCは2つのサブクラスターに分類できる事が明らかになりました。(B)特に、RGC-1ではABCA1欠損に伴って特異的に細胞数が減少していました。(C)RGC-1では、ABCA1欠損によりGrin3a (NR3Aをコードする遺伝子)発現が顕著に減少していました。 (A) アストロサイトABCA1欠損による緑内障様症状。AstroKOマウスは眼圧に変化は示さないものの、12カ月齢でRGCの脱落、網膜菲薄化、軸索障害や視覚機能障害など正常眼圧緑内障様症状を示します。(B) アストロサイトABCA1欠損による緑内障発症の分子メカニズム。ABCA1が欠損するとアストロサイト内にコレステロールが蓄積し、この事による細胞機能障害がアストロサイトからのケモカイン(CXCL12やCCL5など)の産生を誘導します。RGCのサブタイプはNR3Aを高発現しており、ABCA1欠損によってNR3Aの発現が低下します。これによってグルタミン酸によるシグナルが過剰となり、興奮毒性が生じてRGCの細胞死が誘導されると考えられました。
(A) アストロサイトABCA1欠損による緑内障様症状。AstroKOマウスは眼圧に変化は示さないものの、12カ月齢でRGCの脱落、網膜菲薄化、軸索障害や視覚機能障害など正常眼圧緑内障様症状を示します。(B) アストロサイトABCA1欠損による緑内障発症の分子メカニズム。ABCA1が欠損するとアストロサイト内にコレステロールが蓄積し、この事による細胞機能障害がアストロサイトからのケモカイン(CXCL12やCCL5など)の産生を誘導します。RGCのサブタイプはNR3Aを高発現しており、ABCA1欠損によってNR3Aの発現が低下します。これによってグルタミン酸によるシグナルが過剰となり、興奮毒性が生じてRGCの細胞死が誘導されると考えられました。




