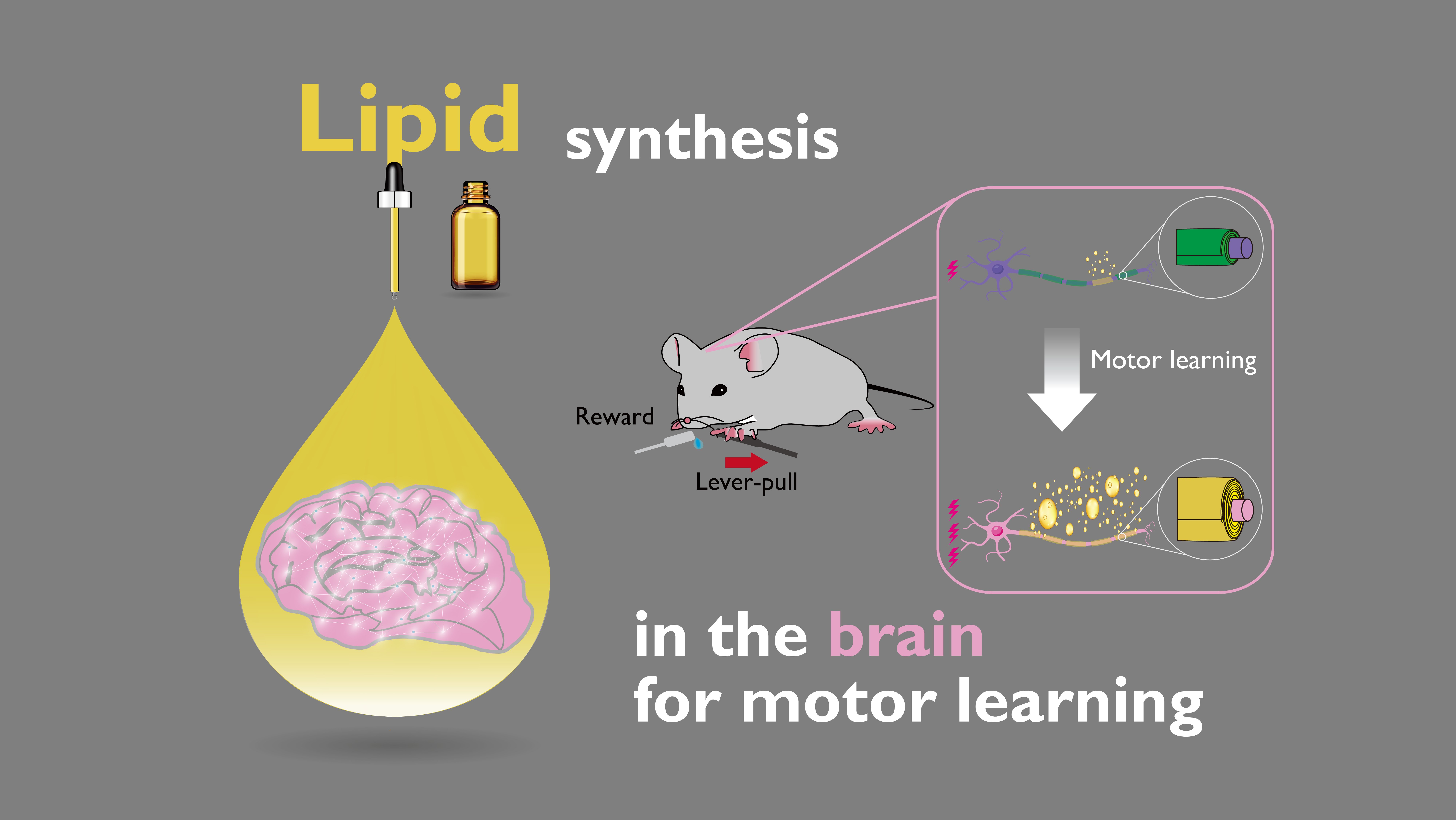
ポイント
○運動学習により、運動野直下に存在する白質の脂質組成がダイナミックに変化することが分かりました。
○この運動学習に伴う脂質組成の変化量は、学習に関連する神経活動の強度と正の相関をすることが分かりました。
○さらに髄鞘を形成するオリゴデンドロサイト特異的に脂質の1つであるガラクトセラミド(GalCer)の合成を阻害すると、運動学習が損われることも分かりました。
○本研究による髄鞘内の詳細な脂質組成とそれらの運動学習への寄与の解明は、病態が髄鞘の変化に伴って進行することが知られるアルツハイマー型認知症や多発性硬化症への治療戦略が創出されることが期待されます。
要旨
国立大学法人 東海国立大学機構 名古屋大学大学院医学系研究科分子細胞学分野の青山友紀 博士課程大学院生、加藤大輔 講師、和氣弘明 教授らの研究グループは、脳内の神経細胞の出力部である軸索の周囲を絶縁するために形成される髄鞘に着目し、運動学習に伴って引き起こされる神経細胞の活動変化によって髄鞘の構成成分である脂質の組成変化が起こり、これが運動学習に必須であること及びその詳細なメカニズムを明らかにしました。
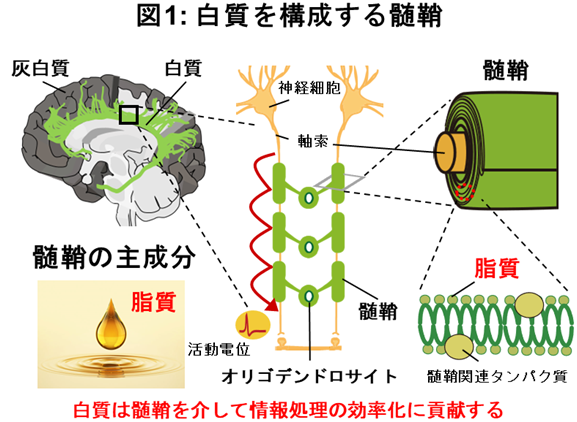
脳には主に神経細胞とその連結部であるシナプスによって構成される灰白質と出力線維である軸索、それを取り巻く髄鞘(注1)から構成される白質が存在します。それぞれコンピューターとそのケーブルのような役割を果たし、そこには電気信号によって情報を送信する神経細胞やその機能をサポートするグリア細胞が存在しています。グリア細胞の1つであるオリゴデンドロサイトは髄鞘を軸索周囲に形成し、神経伝導速度を時間的に制御します。この髄鞘は脂質に富んだ構造であることが知られ、これによって白質は白色(脂質)を呈し、この脂質によって絶縁体として機能します。近年、この髄鞘の可塑的変化によってケーブル内を伝わる活動電位の伝播速度が変化することが知られるようになり、これが神経細胞間の情報伝達に寄与することも明らかとなっています。また、ヒト頭部Magnetic Resonance Imaging(MRI)を用いた研究により、ピアノ演奏やジャグリングなどの訓練によって、関連する脳領域の白質に構造的な変化が起こることが報告され、この変化がこれらの訓練に伴って引き起こされる神経活動依存的に起こること、及びこの変化が技術の取得に必要であることが示唆されてきました。さらに、齧歯類を用いた頭部MRI研究により、この白質の可塑的構造変化は、髄鞘の構成タンパク質の発現と相関があることも明らかとなり、髄鞘の可塑的構造変化を担うメカニズムが着目されています。本研究では、運動学習に伴う髄鞘を構成する脂質成分に着目し、この詳細な脂質組成の変化を明らかにするとともに、その運動学習への寄与を示しました。本研究によって、病態が髄鞘の変化に伴って進行することが知られるアルツハイマー型認知症や多発性硬化症への治療戦略が創出されることが期待されます。本研究成果は「GLIA」の電子版(2023年7月20日付)に掲載されました。 |
1.背景
脳は神経細胞やシナプスが存在する灰白質とそれをつなぐケーブルの役割を果たす白質でできています。白質はオリゴデンドロサイトによって髄鞘化された軸索で構成され、活動電位の伝播速度の増加やエネルギー供給に重要な役割を果たしています(図1)。近年、脳MRI研究により、白質の中でも特に、髄鞘の構造やその構成成分が神経活動の強度に応じて変化することが示され、とりわけ、特定の脳領域における髄鞘を構成するタンパク質発現の増加は、運動学習や技能習得と大きく関わることが知られています。このように、これまでの神経活動と髄鞘に関する研究は、学習によるその構成成分であるタンパク質発現に着目した研究が多く、学習による髄鞘の主要な構成成分である脂質組成の変化やそれに伴う神経活動への寄与はまったく分かっていませんでした。
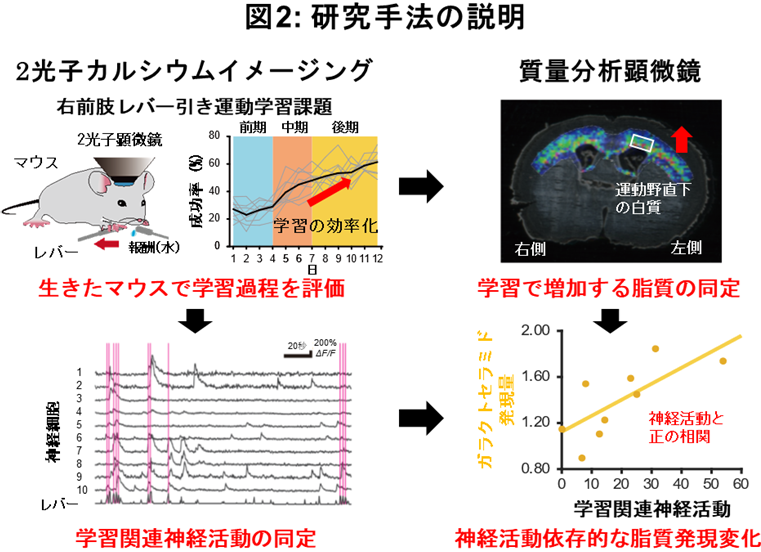
そこで本研究では、髄鞘の主要構成要素である脂質組成の変化が、運動学習と関連しているかどうかを検討しました。マウスの運動学習課題と1次運動野(M1)にある神経活動の2光子カルシウムイメージング法(注2)を組み合わせ、学習に関連する神経活動を定量化しました。次に脳組織切片上で、その空間位置情報を保ったまま脂質組成を調べることができる質量分析顕微鏡(注3)による解析により、M1直下にある白質に存在する主要な脂質組成を定量化しました。その結果、スフィンゴミエリン(SM)の発現量は運動学習の前期から中期で上昇し、GalCerの発現量は運動学習の中期から後期で上昇することが分かりました。さらに、学習の成績や学習に関連する神経活動の変化が高いマウスほど、これら2つの脂質組成の発現量変化も大きいことが分かりました。最後に、運動学習と髄鞘の脂質組成の変化との因果関係を検証するために、運動学習で変化した脂質組成の1つであるGalCerを合成する酵素であるガラクトシルトランスフェラーゼ(CGT)の発現量をオリゴデンドロサイト特異的に阻害しながら、運動学習を行いました。その結果、運動学習が損われることが分かりました。これらより、運動学習が向上するメカニズムの一端として、髄鞘を形成する脂質組成が神経活動に応じてダイナミックに変化することを明らかにしました。
2.研究成果
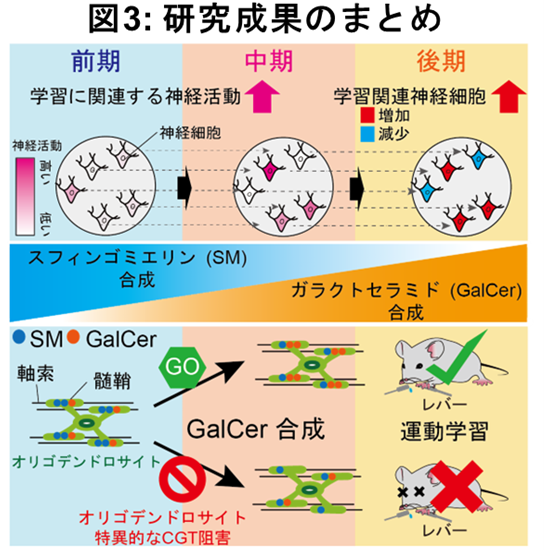
本研究では、レバー引き運動学習に伴うダイナミックな髄鞘内の脂質合成メカニズムとそのレバー引き運動学習への寄与の一端を明らかにしました。今回研究グループは、2光子カルシウムイメージング法、質量分析顕微鏡、電子顕微鏡、電気生理学的手法、分子生物・遺伝学的手法などのアプローチを用い(図2)、運動学習が向上する過程において、(1)成功したレバーを引く動作に関連するM1の神経活動が増加すること、(2)神経活動の変化に伴い、M1直下にある白質の脂質組成が変化し、SMおよびGalCerの合成が促進すること、(3)髄鞘を形成するオリゴデンドロサイト特異的にGalCer合成を阻害することで、運動学習が損われることから、GalCer合成が運動学習に必須であることを明らかにしました(図3)。
 (1) 右前肢レバー引き運動学習課題における課題遂行能力と神経活動の変化
(1) 右前肢レバー引き運動学習課題における課題遂行能力と神経活動の変化
はじめに本研究グループは、生きたマウスの脳を観察することができる生体2光子顕微鏡を用いて、右前肢レバー引き運動学習課題(注4)下におけるマウスM1の神経活動を経時的に観察しました。また、運動学習過程を3段階、前期群(運動学習4日間施行)、中期群(運動学習7日間施行)、後期群(運動学習12日間施行)に分類しました。そして、同一の神経細胞の活動強度および活動パターンを比較することで、それぞれの群における学習効率と神経活動の変化を定量化しました。その結果、M1の神経細胞において、成功したレバーを引く動作に関連する活動(学習に関連する神経活動)が観察される神経細胞(学習に関連する神経細胞)が多数存在し、前期群では、この学習に関連する神経活動の強度が学習過程で増加するマウスほど、レバーを引く回数が多いことが分かりました。さらに後期群では、学習に関連する神経活動の強度が学習過程で増加する神経細胞の数が多いマウスほど、レバーを引く成功率が高くなる(学習効率が高い)ことが分かりました。これらの結果より、運動学習の前期では、レバーを引く動作のためにM1の神経活動が誘導され、後期ではこのM1の神経活動が、学習効率を高めるためにレバー引きに特化した神経活動パターンへ変化することが示されました。
(2) 運動学習過程でM1直下にある白質のSMおよびGalCerの発現量の変化は学習遂行時の神経活動と相関する
次に、運動学習で変化する髄鞘特異的な脂質組成の変化を調べるために、質量分析顕微鏡を用いてM1直下の白質における脂質組成変化を定量化しました。ここでは、上記3群の運動学習と神経活動を個体計測したマウスから脳を採取し、脳切片の左側(運動学習側)と右側(運動学習をしていない側)のM1直下にある白質におけるSMとGalCerの発現量を質量分析顕微鏡により計測し、左右比を定量化しました。その結果、SMの発現量は、前期群と中期群で運動学習側が運動学習をしていない側より高く、一方GalCerの発現量は、中期群と後期群で運動学習側が運動学習をしていない側より高いことが分かりました。これに加えて、後期群の脳サンプルを用いたLC-MS/MS(注5)および薄層クロマトグラフィー(注6)の結果もこれまでと同様、後期群でGalCerの発現量が増加することを示していました。
さらに、前期群では、SMの発現量は、学習に関連する神経活動強度の学習過程での増加量と正の相関をすることが分かりました。また、中期群では、興味深いことにSMおよびGalCerの発現量は、学習に関連する神経活動強度の学習過程での増加量と負の相関を示す一方、学習に関連する神経活動が学習過程で増加した神経細胞の割合とは正の相関を示しました。さらに後期群では、GalCerの発現量は、学習に関連する神経活動が学習過程で増加した神経細胞の割合と正の相関を示しました。これらの結果は、SMの発現量は、運動学習前期における学習に関連する神経活動の増加に寄与し、GalCerの発現量は、運動学習中期および後期段階における成功率を維持する神経活動パターンを促進することで、神経回路の調整機能を発揮している可能性が考えられました。
(3) オリゴデンドロサイト特異的なGalCer合成阻害により、運動学習効率は低下する
最後に本研究グループは、GalCerはオリゴデンドロサイトのCGTという酵素によってSMから合成されるため、アデノ随伴ウイルス(注7)によるRNA干渉法(注8)を用いて、オリゴデンドロサイト特異的にCGTを阻害することで、GalCerの合成が運動学習および神経活動の同期的な活動に寄与するか検証しました。その結果、オリゴデンドロサイト特異的なCGT阻害により、運動学習効率が低下することが分かりました。また、運動学習に重要な視床とM1を結ぶ神経回路に着目し、電気生理学的手法を用いて髄鞘が制御する軸索を伝わる活動電位の伝播する時間を調べたところ、CGT阻害により軸索毎で活動電位の伝播する時間のバラツキが有意に大きくなることが分かりました。これらの結果は、オリゴデンドロサイト特異的なCGT阻害が、視床とM1を結ぶ個々の軸索の活動電位の伝播のタイミングを障害することで、運動学習効率を低下させる可能性を示唆しており、髄鞘におけるGalCerの合成が、運動学習に必要不可欠であることが分かりました。
3.今後の展開
本研究は、GalCerの合成が運動学習に関連する神経活動の安定化に役立ち、髄鞘形成の新たな側面として、運動学習の効率化に脂質組成の変化を介した神経活動依存的な髄鞘化(注9)が必要不可欠であることを示唆しています。近年、髄鞘における脂質代謝の異常は、アルツハイマー型認知症などの神経変性疾患と関連していることが知られています。さらに、白質機能の低下は高齢者や神経変性疾患患者において多く認められるため、髄鞘における脂質組成の変化は、加齢や神経変性疾患の進行に寄与している可能性があります。そのため今回の研究成果により、髄鞘において特定の脂質の合成を制御することは、今後、白質機能の低下を伴う疾患に対する新たな治療的戦略につながる可能性があります。
本研究は、学術変革領域 A(JP20H05699 [和氣])、国際共同研究加速基金(JP20KK0170 [和氣])、日本医療研究開発機構の革新的先端研究開発支援事業(AMED-CREST):研究課題名「糖鎖による神経回路形成制御とその破綻:精神疾患の病態解明」の助成を受けて行われました。
4.用語説明
注1: 髄鞘 (ずいしょう)
神経細胞の軸索周囲にグリア細胞の1つであるオリゴデンドロサイトが形成する層状の構造物。軸索を伝わる信号である活動電位を素早く伝える役割がある。
注2: 2光子カルシウムイメージング法
生きたままマウスの脳を観察することができる生体2光子顕微鏡を用い、神経細胞内のカルシウムイオン濃度を光の強度として計測することで、神経活動を観察する方法。
注3: 質量分析顕微鏡
組織切片上で、その位置情報を保ったまま生体の分子を調べることができる顕微鏡。
注4: 右前肢レバー引き運動学習課題
右前足を使って一定時間レバーを引くと水報酬がもらえる学習課題。
注5: LC-MS/MS
液体クロマトグラフ質量分析計と呼ばれ、液体クロマトグラフで分離した分析対象成分をイオン化し、質量分析部で分離してそれらのイオンを検出分析する方法。
注6: 薄層クロマトグラフィー
ガラス等の板上にシリカゲルやセルロース等の吸着剤を薄膜状に固定した薄層プレートを用い、混合物を移動相で展開させてそれぞれの成分に分離する方法。
注7: アデノ随伴ウイルス
元来病原性を持たず、目的遺伝子などの運び屋として安全性が高いウイルス。
注8: RNA干渉法
目的遺伝子のメッセンジャーRNAとかみ合うような人工的なRNAを細胞内に導入し、目的遺伝子の発現を抑制する方法。
注9: 神経活動依存的な髄鞘化
神経活動に応じて白質を構成する髄鞘の構造が変化すること。
論文情報
雑誌名:GLIA
論文タイトル:Regulation of lipid synthesis in myelin modulates neural activity and is required for motor learning
著者名・所属名:Daisuke Kato1,2#*, Yuki Aoyama1#, Kazuki Nishida3, Yutaka Takahashi4, Takumi Sakamoto4, Ikuko Takeda1,2, Tsuyako Tatematsu1, Shiori Go5, Yutaro Saito1, Shiho Kunishima1, Jinlei Cheng1, Lingnan Hou1, Yoshihisha Tachibana3, Shouta Sugio1, Reon Kondo1, Fumihiro Eto4,6, Shumpei Sato4, Andrew J Moorhouse7, Ikuko Yao4,6, Kenji Kadomatsu5, Mitsutoshi Setou4 and Hiroaki Wake1,2,8,9,10*
1. Department of Anatomy and Molecular Cell Biology, Nagoya University Graduate School of Medicine, Nagoya, Japan.
2. Division of Multicellular Circuit Dynamics, National Institute for Physiological Sciences, National Institutes of Natural Sciences, Okazaki, Japan.
3. Division of System Neuroscience, Kobe University Graduate School of Medicine, Kobe, Japan.
4. Department of Cellular and Molecular Anatomy, Hamamatsu University School of Medicine, Hamamatsu, Japan.
5. Institute for Glyco-core Research, Nagoya University, Nagoya, Japan.
6. Department of Biomedical Chemistry, School of Science and Technology, Kwansei Gakuin University, Sanda, Japan.
7. School of Medical Sciences, UNSW Sydney, Sydney, NSW, Australia.
8. Center of Optical Scattering Image Science, Kobe University, Kobe, Japan.
9. Department of Physiological Sciences, Graduate University for Advanced Studies, SOKENDAI, Hayama, 240-0193, Japan.
10. Core Research for Evolutional Science and Technology, Japan Science and Technology Agency, Saitama, Japan.
DOI: 10.1002/glia.24441
お問い合わせ先
【研究者連絡先】
東海国立大学機構 名古屋大学大学院医学系研究科 分子細胞学
教授 和氣 弘明 (わけ ひろあき)
自然科学研究機構 生理学研究所
多細胞回路動態研究部門
教授(兼任) 和氣 弘明 (わけ ひろあき)
【報道連絡先】
東海国立大学機構 名古屋大学医学部・医学系研究科 総務課総務係
自然科学研究機構 生理学研究所 研究力強化戦略室
リリース元


国立大学法人 東海国立大学機構 名古屋大学大学院
自然科学研究機構 生理学研究所
5251