糖尿病は、世界中の成人の10%近くが罹患する慢性代謝疾患と言われています。糖尿病は高血糖を特徴としており、腎障害、神経障害、網膜症など全身に様々な合併症を引き起こす可能性があります。身体に取り込まれたグルコース(糖)は、ミトコンドリアでのエネルギー源になります。ミトコンドリアは常に分裂と融合のサイクルを繰り返しながら、ミトコンドリアの品質と機能を維持しています。分裂と融合のバランスの崩壊は、糖尿病や神経変性疾患など様々な疾患の発症に関与します。糖尿病患者の組織においてミトコンドリアの膨潤や断片化といった形態異常が報告されていたことから、ミトコンドリアの構造・形態を正常化することで全身のミトコンドリアの機能を改善すれば、血糖値を制御し合併症のリスクも減らせるのではないかと仮説を立てました。我々は以前、ミトコンドリアの分裂に関与するDrp1とFilaminの複合体形成を阻害する高血圧治療薬シルニジピンを見出しました(Nishimura et al. Sci Signal. 2018)。本研究では、高血糖モデルマウスの肝臓や骨格筋で見られるミトコンドリアの形態異常に着目し、シルニジピンやその誘導体によるミトコンドリア品質維持より血糖値や脂肪滴を制御する新たな治療法の開発を目指しました。
研究の内容と成果
HepG2細胞を高濃度のグルコース(25 mM)で培養すると、ミトコンドリアが膨潤(形態異常)し、ミトコンドリア機能の指標の1つである酸素消費速度が減少しましたが、シルニジピンがこれらを改善しました。ストレプトゾシンを用いた細胞障害による高血糖モデルマウスにシルニジピンを投与した結果、血糖値が正常なマウスと同程度まで改善しました。シルニジピンを投与していない高血糖マウスでは、骨格筋、肝臓ともミトコンドリア形態が変化していましたが、シルニジピンはこの形態異常を抑制していました。Ob/obマウス(※4)にシルニジピンを投与しても血糖値改善効果は得られず、シルニジピンにインスリンの抑制傾向があることがわかりました。次に、インスリン放出を阻害するCa2+チャネル阻害能をシルニジピンから除去し、ミトコンドリア分裂阻害能のみ保持したシルニジピン誘導体(1,4-DHP)を同定しました。高脂肪食を食べさせたOb/obマウスに1,4-DHPを投与した結果、インスリン放出抑制効果はなく、ミトコンドリア形態異常を抑制し、高血糖を改善しました。同時に、肝臓での脂肪滴の蓄積も減少しました(図1)。
以上の結果から、高血糖や高脂質で引き起こされる組織で見られるミトコンドリア形態異常を抑制することで、グルコース代謝を正常化し血糖値を制御することや脂肪滴の蓄積の改善が示唆されました(図2)。
今後の展開
本研究により、シルニジピンや1,4-DHPを用いて複数の臓器のミトコンドリアの質を正常化することで、全身のグルコース代謝を改善することを見いだしました。今後は、病態下で何をきっかけにして、ミトコンドリアの形態・機能異常が引き起こされるのかを明らかにしていく必要があると考えています。ミトコンドリア形態異常は糖尿病やその合併症だけではなく、心不全や神経変性疾患など様々な疾患においても報告されていることから、これらの疾患に対してミトコンドリアの品質管理を標的とした新たな治療法の開発が期待されます。【参考図】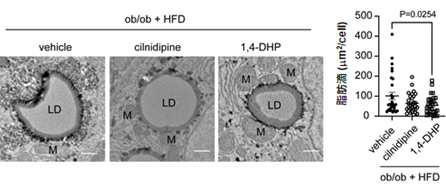 図1
図1 Ob/obマウスの肝臓におけるミトコンドリアと脂肪滴
左:高脂肪食を摂取したOb/obマウスの肝臓の電顕画像M: ミトコンドリア、LD: 脂肪滴
右:1肝細胞中の脂肪滴の面積
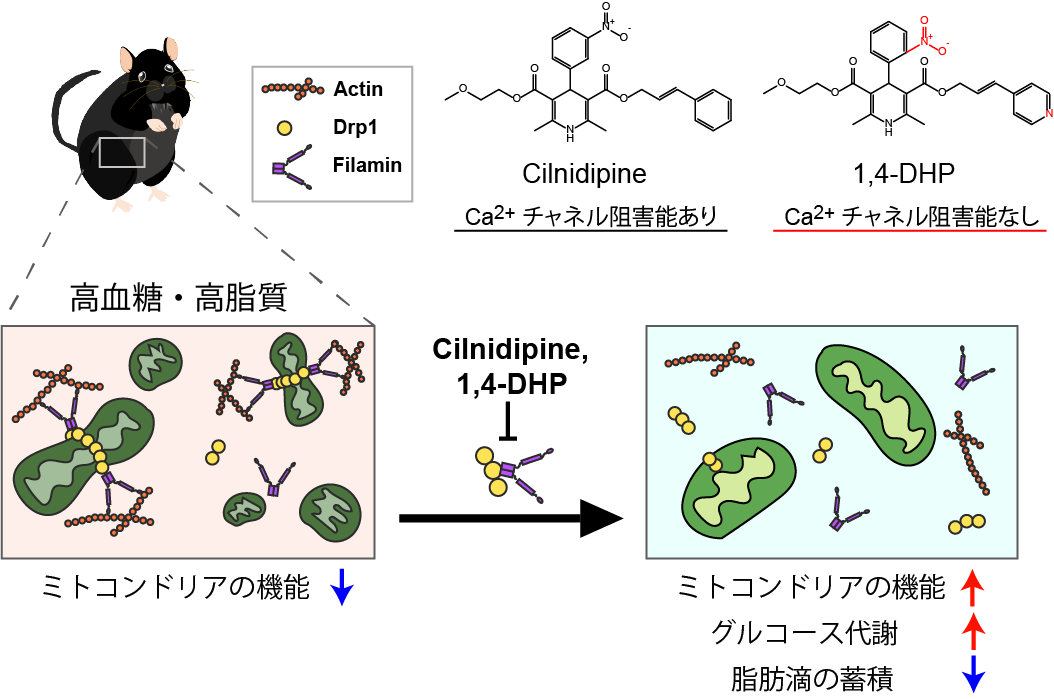 図2
図2 シルニジピンや1,4-DHPによるミトコンドリア品質管理
シルニジピンや1,4-DHPはミトコンドリア過剰分裂に関与するDrp1, Filamin複合体形成を阻害し、ミトコンドリアの形態異常を抑制することでミトコンドリアの機能を維持する
【用語解説】(※1) Drp1
Dynamin-related protein1. ミトコンドリアの分裂に必須の因子。
(※2) Filamin
細胞骨格を司るアクチンに結合するタンパク質。
(※3) 脂肪滴
細胞内で脂質を貯蔵している細胞小器官。脂肪滴の蓄積が様々な疾患に関与することが報告されている。
(※4) Ob/ob マウス
食欲を抑えるレプチンを欠損させた糖尿病モデルマウスの1つ。
【謝辞】本研究はJSPS科研費(JP22H02772, JP22K19395, JP23K06164)、AMED研究費「JP23ama121031」、CREST「JPMJCR2024 (20348438)」、学術変革A(21H05269, 21H05258)などの助成を受けて行われました。
論文情報
掲載誌:British journal of pharmacology
タイトル:Inhibition of Drp1-filamin interaction improves systemic glucose metabolism
著者名:Yuri Kato, Kohei Ariyoshi, Yasunobu Nohara, Naoya Matsunaga, Tsukasa Shimauchi, Naoya Shindo, Akiyuki Nishimura, Xinya Mi, Sang Geon Kim, Tomomi Ide, Eiji Kawanishi, Akio Ojida, Naoki Nakashima, Yasuo Mori, Motohiro Nishida.
DOI:10.1111/bph.16487
掲載誌:International Journal of Molecular Science
タイトル:Inhibition of Drp1-filamin protein complex prevents hepatic lipid droplet accumulation by increasing mitochondria-lipid droplet contact
著者名:Kohei Ariyoshi, Kazuhiro Nishiyama, Yuri Kato, Xinya Mi, Tomoya Ito, Yasu-Taka Azuma, Akiyuki Nishimura, Motohiro Nishida.
DOI:10.3390/ijms25105446.
お問合せ先
<研究に関すること>九州大学大学院薬学研究院生理学分野 教授 西田基宏(ニシダ モトヒロ)
<報道に関すること>九州大学 広報課
自然科学研究機構 生理学研究所 研究力強化戦略室

