ポイント
① 慢性便秘症※1は近年、生命予後にも影響することから注目されている
② 最先端の神経科学的手法を用いて排便をつかさどる脳中枢の仕組みを世界で初めて解明した
③ 今後、慢性便秘症の治療や予防に新たな治療戦略が提供されることが期待される
概要
慢性便秘症は日常生活の質を著しく低下させるだけでなく、長期生命予後にも影響を及ぼすことが知られています。排便には中枢神経系が関与していることは分かっていましたが、脳のどの領域がどのように排便を制御しているのかは未解明でした。
九州大学大学院医学研究院の小川佳宏主幹教授、同大学病院の田中義将助教、佛坂孝太大学院生(現:福岡東医療センター)らの研究グループは、自然科学研究機構生理学研究所の箕越靖彦教授(現:椙山女学園大学 生活科学部 管理栄養学科教授)らとの共同研究により、マウスを用いた最先端のオプトジェネティクス※2などの神経科学的手法を用いて、排便を制御する脳の中枢が主に橋※3の「バリントン核(Barrington’s nucleus)※4」に存在することを初めて実証しました。さらに、同核内の2種類の神経細胞が、それぞれ異なるタイプの排便反応(即時型と遅延型)を担うことを明らかにしました。また、視床下部室傍核や腹外側部水道周囲灰白質といった脳領域が上流からこれらの神経を調節していることも解明しました。
本研究により明らかとなった、中枢神経系による排便制御の具体的な仕組みは、慢性便秘症や排便障害の病態理解を大きく前進させ、将来的には新規治療法の開発に貢献することが期待されます。
本研究成果は米国の医学雑誌「Cellular and Molecular Gastroenterology and Hepatology」に2025年10月10日(金)午後10時(日本時間)に掲載されました。
|
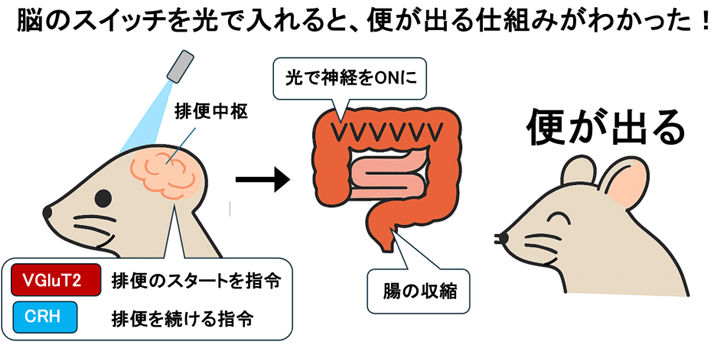
(図1) バリントン核に対する光遺伝学を用いた便秘治療への試み
研究者からひとこと:
排便を制御する脳の中枢を明らかにし、2種類の神経群が異なる役割で排便を引き起こすことを明らかにしました。今回の研究成果により慢性便秘症の病態理解を進めていくとともに、新しい便秘治療の開発を目指します。
(田中義将)
【研究の背景と経緯】
慢性便秘症は生活の質に影響を及ぼすとともに近年、循環器疾患と脳血管疾患のリスク要因となり、慢性便秘症患者の生存率は健常人よりも15年生存率が20%以上低いことが明らかとなり、注目されています。慢性便秘症は、排便回数の減少を主症状とする大腸通過遅延型と排便困難を主症状とする便排出障害型に大別されます。正常な排便は、腹圧などによる直腸圧の上昇と肛門の弛緩による協調運動により達せられます。協調運動に異常を来した状態が便排出障害型の慢性便秘症ですが、その協調運動をつかさどる脳排便中枢の詳細に関しては解明されていませんでした。
【研究の内容と成果】
本研究グループは、マウスを用いた最先端の神経科学的手法により、脳の橋にあるバリントン核(Barrington’s nucleus: Bar)が排便を制御していること、さらにその内部の異なる神経群が排便の開始や持続に異なる役割を果たしていることを初めて明らかにしました。
まず、神経軸索を逆行性に移動する性質を持つ「仮性狂犬病ウイルス
※5(PRV152, PRV614)」を遺伝子改変マウスの肛門および直腸に注射し、脳内の排便中枢を探索しました。その結果、バリントン核(Bar)と青斑核(LC)
※4が排便制御に関与している可能性が示されました。
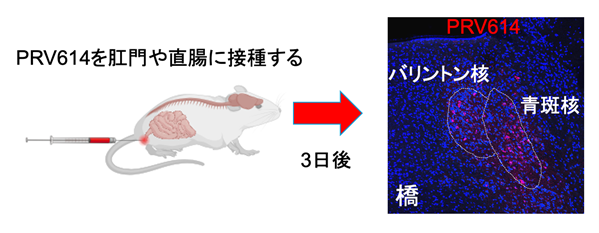
(図2) 仮性狂犬病ウイルスを用いた排便中枢の探索
次に、オプトジェネティクスを用いて脳内の特定神経を刺激し、腸の内圧や直腸に入れたガラスビーズの排泄時間を測定しました。その結果、バリントン核と青斑核のVGluT2神経
※6が、即時かつ非持続的な腸管収縮を引き起こし、排便開始時のぜん動に関与していることが示唆されました。一方、バリントン核のCRH神経
※6は遅れて持続する腸管収縮を引き起こし、排便開始後の持続的なぜん動を担うことが判明しました。
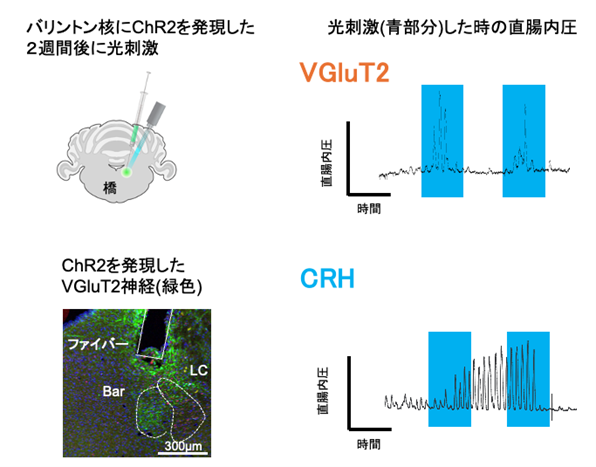
(図3) オプトジェネティクスを用いた排便中枢刺激による腸管収縮の様子
チャネルロドプシン2(ChR2)という膜タンパク質を発現させた神経細胞に青色光を照射すると、人為的に神経を興奮させることができる(図左上、左下)。オプトジェネティクスと呼ばれるこの手法を用いてバリントン核の神経活動と直腸内圧の関係を調べたところ、VGluT2神経を興奮させた時には即時かつ非持続的に直腸内圧が上昇し(図右上)、CRH神経を興奮させた時には直腸内圧はやや遅れて持続的に上昇した(図右下)。
さらにDREADD法
※7を用いて神経を活性化すると、いずれの群でも便重量と便個数の増加が認められました。また、ファイバーフォトメトリー法
※8により、自然排便時にこれらの神経が最大限に活動していることも確認されました。
加えて、改変仮性狂犬病ウイルスPRVB180を用いた解析により、腹外側部水道周囲灰白質(vlPAG)と視床下部室傍核(PVH)がバリントン核と青斑核を介して排便に関与する上位中枢であることを突き止めました。光遺伝学的刺激実験でも、これらの上位中枢がバリントン核と青斑核を経由して排便を誘発することが確認されました。
【今後の展開】
本研究では遺伝子改変マウスを用いて、仮性狂犬病ウイルス、オプトジェネティクス、DREADD 法、ファイバーフォトメトリー法を組み合わせることで、バリントン核が橋に存在する排便の中枢であることを証明しました。さらにバリントン核内の異なる神経群(VGluT2神経とCRH神経)がそれぞれ異なるメカニズムで排便を制御することを世界で初めて実証しました。本研究成果は、中枢の排便メカニズムに関する新たな洞察をもたらし、便排出障害の病態解明や新しい治療戦略の開発につながることが期待されます。
用語解説
(※1) 慢性便秘症(大腸通過遅延型と便排出障害型)
慢性便秘症の分類。大腸通過遅延型は大腸が便を送る動きが悪いため、排便の回数や量が減少する便秘である。一方、便排出障害型は直腸まで便が下りてきているのに、肛門の外に押し出す力が弱くなりスムーズな排便ができない便秘である。今回の研究は便排出障害型の原因の解明につながることが期待される。
(※2) オプトジェネティクス
光によって活性化されるタンパク分子を遺伝学的手法を用いて特定の細胞に発現させ、その機能を光で操作する技術である。光(opto)と遺伝学(genetics)を組み合わせたことから光遺伝学と呼ばれる。光遺伝学の開発により、特定の神経の活動を高い時間精度で正確に操作することが初めて可能となった。
オプトジェネティクスでは、光感受性チャネルを細胞に発現させることが前提になるため、本研究における実験では、ウイルスを接種することで発現させている。これまでに様々な光感受性チャネルが開発されており、今回用いたチャネルロドプシン2(ChR2)という光感受性チャネルを発現する神経細胞であれば、光照射によってナトリウムイオンが細胞に流入し、膜電位が脱分極し、これが引き金となって軸索起始部にある電位作動性のナトリウムチャネルが開き、活動電位が発生して神経興奮を起こす。なお、用いる光感受性チャネルを変えれば神経抑制を起こすことも可能である(本論文ではstGtACR2を使用)。
(※3) 橋
脳の部位の一つ。脳幹という生命維持に関与する意識・呼吸・循環などを調節する領域に存在する。
(※4) バリントン核と青斑核
バリントン核は脳幹の橋にある神経核で、主に排尿の調節に関わっていて排尿中枢として以前より知られていた。青斑核はバリントン核の近傍に存在し、同じく脳幹の橋にある神経核である。覚醒レベルの制御、選択的注意、ストレス反応、痛みの抑制、そして意志力や情動、記憶の形成・消去など、幅広い認知機能と生理機能に深く関与することが知られている。両者は排便中枢である可能性についても知られていたが実験手法の問題から詳細な場所や役割は不明であった。
(※5) 仮性狂犬病ウイルス
神経細胞に感染すると増殖し、シナプス結合を介して接続する上流の神経細胞へと特異的に輸送される。仮性狂犬病ウイルスのこの性質を用いて、特定の神経細胞にシナプス結合する、上流の神経細胞群に外来タンパク質を発現させることが可能である。
本研究における実験で用いる遺伝子組換え仮性狂犬病ウイルスは、Creリコンビナーゼ(DNA組換え反応を触媒する酵素のひとつ)を発現する神経細胞に感染すると上流の神経細胞に輸送される性質を持つため、Cre発現細胞の上流の神経細胞を網羅的に高感度で同定できる、非常に強力な手法である。
(※6) VGluT2神経とCRH神経
VGluT2(小胞性グルタミン酸トランスポーター2)はグルタミン酸を貯蔵するタンパク質であり、CRH(副腎皮質刺激ホルモン放出ホルモン)は視床下部から分泌されるホルモンである。それぞれを次の神経に情報伝達する際に分泌する異なる神経群のことである。
(※7) DREADD 法(Designer Receptors Exclusively Activated by Designer Drug)
神経伝達物質アセチルコリンの受容体の一つ、ムスカリン受容体のアミノ酸配列を一部変更した受容体を用いて、特定の神経細胞の神経活動を増加または抑制する方法。受容体にはいくつかの種類があり、神経活動を高めるためにはhM3Dq受容体を、抑制するためにはhM4Diを主に用いる。hM3DqとhM4Diは、生体内に存在するアセチルコリンには反応しないが、薬物CNO (Clozapine-N-Oxide) によって特異的に活性化または抑制する。この受容体を特定の神経細胞に発現させた後、CNOを投与することによって、目的とする神経細胞の活動を変更することが可能である。CNOは、飲料水に入れて摂取させる、または注射することによって、脳の中に入り、神経活動を操作できる。本研究における実験では、VGluT2神経やCRH神経にhM3DqやhM4diを発現させ、CNOをマウスに注射することによって同ニューロンの神経活動を操作した。
(※8) ファイバーフォトメトリー法
生体内で特定の神経集団の活動をリアルタイムに記録する技術で、GCaMPに代表されるカルシウム感受性蛍光タンパク質を神経に発現させ、光ファイバーで励起光を当てて蛍光変化を検出する。これにより、行動中の動物の脳活動を非侵襲的に、かつ長期間モニタリングできる。
本研究における実験では、自然排便中のVGluT2神経とCRH神経の神経活動をモニタリングした。
【謝辞】
本研究はJSPS科研費 (JP20K17054, JP22H04993, JP22K19530, JP23K15073)、AMED革新的先端研究開発支援事業PRIME(JP23gm6510025)「直腸知覚による脳排便中枢を介した排便機構の解明(研究開発代表者:田中義将)」、AMED-CREST(JP16gm0610011)「細胞間相互作用と臓器代謝ネットワークの破綻による組織線維化の制御機構の解明と医学応用(研究開発代表者:小川佳宏)、公益財団法人日本応用酵素協会 成人病の病因・病態の解明に関する研究助成、生理学研究所 共同利用研究 (21NIPS113, 22NIPS123, 23NIPS117) の助成を受けたものです。
論文情報
掲載誌:Cellular and Molecular Gastroenterology and Hepatology
タイトル:Barrington’s nucleus: a pontine defecation brain area exhibiting prompt and delayed
defecation responses
著者名:Kota Bussaka, Yoshimasa Tanaka, Kunio Kondoh, Ken-ichiro Nakajima, Takatoshi Chinen, Xiaopeng Bai, Yosuke Minoda, Hiroko Ikeda, Kazuki Inamura, Tsubasa Takeshima, Haruei Ogino, Eikichi Ihara, Yasuhiko Minokoshi, Yoshihiro Ogawa
DOI:判明次第、九州大学HPにてお知らせいたします。
(九州大学HP:
https://www.kyushu-u.ac.jp/ja/researches/view/1340)
お問合せ先
<研究に関すること>
九州大学病院 肝臓・膵臓・胆道内科 助教 田中 義将(タナカ ヨシマサ)
九州大学大学院医学研究院 病態制御内科学 主幹教授 小川 佳宏(オガワ ヨシヒロ)
<報道に関すること>
九州大学 広報課
自然科学研究機構 生理学研究所 研究力強化戦略室
リリース元


九州大学
自然科学研究機構 生理学研究所




